CN101273056A - 表位类似物 - Google Patents
表位类似物 Download PDFInfo
- Publication number
- CN101273056A CN101273056A CNA2006800300090A CN200680030009A CN101273056A CN 101273056 A CN101273056 A CN 101273056A CN A2006800300090 A CNA2006800300090 A CN A2006800300090A CN 200680030009 A CN200680030009 A CN 200680030009A CN 101273056 A CN101273056 A CN 101273056A
- Authority
- CN
- China
- Prior art keywords
- peptide
- seq
- nva
- nle
- analogue
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 697
- 102000004196 processed proteins & peptides Human genes 0.000 claims abstract description 183
- 238000000034 method Methods 0.000 claims abstract description 141
- 210000001744 T-lymphocyte Anatomy 0.000 claims abstract description 66
- 235000001014 amino acid Nutrition 0.000 claims description 199
- 150000001413 amino acids Chemical class 0.000 claims description 192
- 239000000203 mixture Substances 0.000 claims description 73
- 102000036673 PRAME Human genes 0.000 claims description 63
- 108060006580 PRAME Proteins 0.000 claims description 63
- 239000013612 plasmid Substances 0.000 claims description 63
- 150000007523 nucleic acids Chemical class 0.000 claims description 58
- 108020004707 nucleic acids Proteins 0.000 claims description 57
- 102000039446 nucleic acids Human genes 0.000 claims description 57
- 230000002163 immunogen Effects 0.000 claims description 54
- 108010074032 HLA-A2 Antigen Proteins 0.000 claims description 41
- 102000025850 HLA-A2 Antigen Human genes 0.000 claims description 41
- 229920001184 polypeptide Polymers 0.000 claims description 39
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 claims description 39
- 102100028389 Melanoma antigen recognized by T-cells 1 Human genes 0.000 claims description 36
- 102000004316 Oxidoreductases Human genes 0.000 claims description 35
- 108090000854 Oxidoreductases Proteins 0.000 claims description 35
- 108010010995 MART-1 Antigen Proteins 0.000 claims description 32
- 230000005867 T cell response Effects 0.000 claims description 11
- 230000005859 cell recognition Effects 0.000 claims description 10
- 230000003308 immunostimulating effect Effects 0.000 claims description 9
- 229960001438 immunostimulant agent Drugs 0.000 claims description 8
- 239000003022 immunostimulating agent Substances 0.000 claims description 8
- 229920001481 poly(stearyl methacrylate) Polymers 0.000 claims description 5
- 229910052698 phosphorus Inorganic materials 0.000 claims description 3
- 101710198884 GATA-type zinc finger protein 1 Proteins 0.000 claims description 2
- DTHNMHAUYICORS-KTKZVXAJSA-N Glucagon-like peptide 1 Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(N)=O)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC=1N=CNC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=CC=C1 DTHNMHAUYICORS-KTKZVXAJSA-N 0.000 claims description 2
- 102100041003 Glutamate carboxypeptidase 2 Human genes 0.000 claims 2
- 101000892862 Homo sapiens Glutamate carboxypeptidase 2 Proteins 0.000 claims 2
- 102400000322 Glucagon-like peptide 1 Human genes 0.000 claims 1
- SNDPXSYFESPGGJ-UHFFFAOYSA-N L-norVal-OH Natural products CCCC(N)C(O)=O SNDPXSYFESPGGJ-UHFFFAOYSA-N 0.000 abstract description 224
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 abstract description 200
- 230000001900 immune effect Effects 0.000 abstract description 38
- 230000001976 improved effect Effects 0.000 abstract description 24
- SNDPXSYFESPGGJ-BYPYZUCNSA-N L-2-aminopentanoic acid Chemical compound CCC[C@H](N)C(O)=O SNDPXSYFESPGGJ-BYPYZUCNSA-N 0.000 abstract description 14
- 125000003275 alpha amino acid group Chemical group 0.000 abstract description 14
- 238000006467 substitution reaction Methods 0.000 abstract description 8
- 108700018351 Major Histocompatibility Complex Proteins 0.000 description 205
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 description 205
- 229940024606 amino acid Drugs 0.000 description 190
- 210000004027 cell Anatomy 0.000 description 115
- 206010028980 Neoplasm Diseases 0.000 description 87
- 239000000427 antigen Substances 0.000 description 87
- 108091007433 antigens Proteins 0.000 description 87
- 102000036639 antigens Human genes 0.000 description 87
- 230000000694 effects Effects 0.000 description 87
- 102200151424 rs5198 Human genes 0.000 description 86
- 230000009260 cross reactivity Effects 0.000 description 84
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 73
- 101000880770 Homo sapiens Protein SSX2 Proteins 0.000 description 70
- 102100037686 Protein SSX2 Human genes 0.000 description 70
- 230000036039 immunity Effects 0.000 description 68
- QWCKQJZIFLGMSD-UHFFFAOYSA-N alpha-aminobutyric acid Chemical compound CCC(N)C(O)=O QWCKQJZIFLGMSD-UHFFFAOYSA-N 0.000 description 59
- 230000006872 improvement Effects 0.000 description 48
- 102100037850 Interferon gamma Human genes 0.000 description 46
- 108010074328 Interferon-gamma Proteins 0.000 description 46
- 102100025570 Cancer/testis antigen 1 Human genes 0.000 description 43
- 101000856237 Homo sapiens Cancer/testis antigen 1 Proteins 0.000 description 43
- 230000003993 interaction Effects 0.000 description 43
- 230000004048 modification Effects 0.000 description 43
- 238000012986 modification Methods 0.000 description 43
- 230000004044 response Effects 0.000 description 39
- 230000006870 function Effects 0.000 description 38
- 238000001514 detection method Methods 0.000 description 36
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 35
- 241000699666 Mus <mouse, genus> Species 0.000 description 34
- 210000004988 splenocyte Anatomy 0.000 description 34
- 201000011510 cancer Diseases 0.000 description 32
- 230000005847 immunogenicity Effects 0.000 description 32
- 108010088729 HLA-A*02:01 antigen Proteins 0.000 description 30
- 210000004881 tumor cell Anatomy 0.000 description 28
- KDXKERNSBIXSRK-RXMQYKEDSA-N D-lysine Chemical compound NCCCC[C@@H](N)C(O)=O KDXKERNSBIXSRK-RXMQYKEDSA-N 0.000 description 26
- 230000000875 corresponding effect Effects 0.000 description 23
- 238000001727 in vivo Methods 0.000 description 21
- 230000001939 inductive effect Effects 0.000 description 20
- 241000699660 Mus musculus Species 0.000 description 19
- 210000001165 lymph node Anatomy 0.000 description 19
- 238000011830 transgenic mouse model Methods 0.000 description 19
- 108090000695 Cytokines Proteins 0.000 description 18
- 102000004127 Cytokines Human genes 0.000 description 18
- 238000005336 cracking Methods 0.000 description 18
- 230000008859 change Effects 0.000 description 17
- 238000013461 design Methods 0.000 description 17
- 230000002209 hydrophobic effect Effects 0.000 description 17
- -1 PSMA Proteins 0.000 description 16
- 238000011534 incubation Methods 0.000 description 16
- 230000008569 process Effects 0.000 description 16
- 238000011160 research Methods 0.000 description 16
- 230000001988 toxicity Effects 0.000 description 16
- 231100000419 toxicity Toxicity 0.000 description 16
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Chemical compound CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 15
- 231100000135 cytotoxicity Toxicity 0.000 description 15
- 230000003013 cytotoxicity Effects 0.000 description 15
- 238000011081 inoculation Methods 0.000 description 15
- 125000000539 amino acid group Chemical group 0.000 description 14
- 201000001441 melanoma Diseases 0.000 description 14
- 239000013642 negative control Substances 0.000 description 14
- KZSNJWFQEVHDMF-SCSAIBSYSA-N D-valine Chemical compound CC(C)[C@@H](N)C(O)=O KZSNJWFQEVHDMF-SCSAIBSYSA-N 0.000 description 13
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 13
- AKCRVYNORCOYQT-YFKPBYRVSA-N N-methyl-L-valine Chemical compound CN[C@@H](C(C)C)C(O)=O AKCRVYNORCOYQT-YFKPBYRVSA-N 0.000 description 13
- 150000001408 amides Chemical class 0.000 description 13
- 230000000890 antigenic effect Effects 0.000 description 13
- UKAUYVFTDYCKQA-UHFFFAOYSA-N homoserine Chemical compound OC(=O)C(N)CCO UKAUYVFTDYCKQA-UHFFFAOYSA-N 0.000 description 13
- 238000002360 preparation method Methods 0.000 description 13
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 12
- FUOOLUPWFVMBKG-UHFFFAOYSA-N 2-Aminoisobutyric acid Chemical compound CC(C)(N)C(O)=O FUOOLUPWFVMBKG-UHFFFAOYSA-N 0.000 description 12
- QNAYBMKLOCPYGJ-UWTATZPHSA-N D-alanine Chemical compound C[C@@H](N)C(O)=O QNAYBMKLOCPYGJ-UWTATZPHSA-N 0.000 description 12
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 12
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 12
- 238000004043 dyeing Methods 0.000 description 12
- 239000012634 fragment Substances 0.000 description 12
- 230000001225 therapeutic effect Effects 0.000 description 12
- 125000001165 hydrophobic group Chemical group 0.000 description 11
- 238000011282 treatment Methods 0.000 description 11
- 229960005486 vaccine Drugs 0.000 description 11
- 101150080480 A27L gene Proteins 0.000 description 10
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 10
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 10
- 101100268532 Vaccinia virus (strain Western Reserve) VACWR150 gene Proteins 0.000 description 10
- 238000004458 analytical method Methods 0.000 description 10
- 230000008901 benefit Effects 0.000 description 10
- 230000002349 favourable effect Effects 0.000 description 10
- 230000002787 reinforcement Effects 0.000 description 10
- 238000012360 testing method Methods 0.000 description 10
- 102220551767 Guanylate-binding protein 1_I46L_mutation Human genes 0.000 description 9
- 102220473084 HLA class II histocompatibility antigen, DP alpha 1 chain_A42M_mutation Human genes 0.000 description 9
- 238000004422 calculation algorithm Methods 0.000 description 9
- 238000006073 displacement reaction Methods 0.000 description 9
- 239000013604 expression vector Substances 0.000 description 9
- 230000000977 initiatory effect Effects 0.000 description 9
- 230000009466 transformation Effects 0.000 description 9
- 230000003053 immunization Effects 0.000 description 8
- 238000002649 immunization Methods 0.000 description 8
- 230000001965 increasing effect Effects 0.000 description 8
- 102200100439 rs2304681 Human genes 0.000 description 8
- 102220091022 rs876657965 Human genes 0.000 description 8
- 238000010572 single replacement reaction Methods 0.000 description 8
- 210000000952 spleen Anatomy 0.000 description 8
- LZOIGVDSAMDBIO-LXWJMTKESA-N (2S)-2-[[(2S,3R)-2-[[(2S)-2-[[(2S,3S)-2-[[(2S)-4-amino-2-[[(2S,3S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-amino-4-methylsulfanylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-3-phenylpropanoyl]amino]-3-methylpentanoyl]amino]-4-oxobutanoyl]amino]-3-methylpentanoyl]amino]-4-methylpentanoyl]amino]-3-hydroxybutanoyl]amino]-4-methylpentanoic acid Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O)[C@@H](C)CC)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@@H](N)CCSC)C1=CC=CC=C1 LZOIGVDSAMDBIO-LXWJMTKESA-N 0.000 description 7
- 102100039510 Cancer/testis antigen 2 Human genes 0.000 description 7
- 101000889345 Homo sapiens Cancer/testis antigen 2 Proteins 0.000 description 7
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 7
- 241001465754 Metazoa Species 0.000 description 7
- 231100000433 cytotoxic Toxicity 0.000 description 7
- 230000001472 cytotoxic effect Effects 0.000 description 7
- 238000000684 flow cytometry Methods 0.000 description 7
- 230000001788 irregular Effects 0.000 description 7
- 210000004698 lymphocyte Anatomy 0.000 description 7
- 201000009030 Carcinoma Diseases 0.000 description 6
- 238000002965 ELISA Methods 0.000 description 6
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 6
- 108010066345 MHC binding peptide Proteins 0.000 description 6
- 101100462972 Mus musculus Pcdh8 gene Proteins 0.000 description 6
- 210000000612 antigen-presenting cell Anatomy 0.000 description 6
- 210000004369 blood Anatomy 0.000 description 6
- 239000008280 blood Substances 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 6
- 239000002299 complementary DNA Substances 0.000 description 6
- 201000010099 disease Diseases 0.000 description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 6
- 238000010494 dissociation reaction Methods 0.000 description 6
- 230000005593 dissociations Effects 0.000 description 6
- 238000002474 experimental method Methods 0.000 description 6
- 238000005259 measurement Methods 0.000 description 6
- 238000005457 optimization Methods 0.000 description 6
- 210000005105 peripheral blood lymphocyte Anatomy 0.000 description 6
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 6
- 108090000623 proteins and genes Proteins 0.000 description 6
- 102220308022 rs1553602871 Human genes 0.000 description 6
- 210000001550 testis Anatomy 0.000 description 6
- 102100025064 Cellular tumor antigen p53 Human genes 0.000 description 5
- 101000578784 Homo sapiens Melanoma antigen recognized by T-cells 1 Proteins 0.000 description 5
- 125000000393 L-methionino group Chemical group [H]OC(=O)[C@@]([H])(N([H])[*])C([H])([H])C(SC([H])([H])[H])([H])[H] 0.000 description 5
- 241000699670 Mus sp. Species 0.000 description 5
- 102000004245 Proteasome Endopeptidase Complex Human genes 0.000 description 5
- 108090000708 Proteasome Endopeptidase Complex Proteins 0.000 description 5
- 239000002253 acid Substances 0.000 description 5
- 210000004899 c-terminal region Anatomy 0.000 description 5
- 230000000295 complement effect Effects 0.000 description 5
- 230000034994 death Effects 0.000 description 5
- 238000005516 engineering process Methods 0.000 description 5
- 238000003114 enzyme-linked immunosorbent spot assay Methods 0.000 description 5
- 230000002068 genetic effect Effects 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 210000002751 lymph Anatomy 0.000 description 5
- 238000012423 maintenance Methods 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
- 239000002609 medium Substances 0.000 description 5
- 230000002265 prevention Effects 0.000 description 5
- 230000017854 proteolysis Effects 0.000 description 5
- 102220221476 rs1060503624 Human genes 0.000 description 5
- 229920006395 saturated elastomer Polymers 0.000 description 5
- 230000028327 secretion Effects 0.000 description 5
- 241000894007 species Species 0.000 description 5
- 238000005728 strengthening Methods 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- 238000005406 washing Methods 0.000 description 5
- 125000001433 C-terminal amino-acid group Chemical group 0.000 description 4
- 102100025475 Carcinoembryonic antigen-related cell adhesion molecule 5 Human genes 0.000 description 4
- ROHFNLRQFUQHCH-RXMQYKEDSA-N D-leucine Chemical compound CC(C)C[C@@H](N)C(O)=O ROHFNLRQFUQHCH-RXMQYKEDSA-N 0.000 description 4
- 102100037020 Melanoma antigen preferentially expressed in tumors Human genes 0.000 description 4
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 4
- 101710100968 Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 4
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 230000017488 activation-induced cell death of T cell Effects 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 4
- 230000001413 cellular effect Effects 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 230000002708 enhancing effect Effects 0.000 description 4
- 230000028993 immune response Effects 0.000 description 4
- 238000009169 immunotherapy Methods 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 239000013641 positive control Substances 0.000 description 4
- 239000002243 precursor Substances 0.000 description 4
- 238000000926 separation method Methods 0.000 description 4
- 108020004414 DNA Proteins 0.000 description 3
- 101710181478 Envelope glycoprotein GP350 Proteins 0.000 description 3
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 3
- 101001095088 Homo sapiens Melanoma antigen preferentially expressed in tumors Proteins 0.000 description 3
- XHAZJQSTGGLMLZ-MSDGEDAMSA-N N([C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(O)=O)C(=O)[C@@H]1CCCN1C(=O)[C@H](CC(C)C)NC(=O)CN Chemical compound N([C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(O)=O)C(=O)[C@@H]1CCCN1C(=O)[C@H](CC(C)C)NC(=O)CN XHAZJQSTGGLMLZ-MSDGEDAMSA-N 0.000 description 3
- XUYPXLNMDZIRQH-LURJTMIESA-N N-acetyl-L-methionine Chemical compound CSCC[C@@H](C(O)=O)NC(C)=O XUYPXLNMDZIRQH-LURJTMIESA-N 0.000 description 3
- DZHDVYLBNKMLMB-ZFWWWQNUSA-N Trp-Lys Chemical compound C1=CC=C2C(C[C@H](N)C(=O)N[C@@H](CCCCN)C(O)=O)=CNC2=C1 DZHDVYLBNKMLMB-ZFWWWQNUSA-N 0.000 description 3
- 125000003118 aryl group Chemical group 0.000 description 3
- 238000003556 assay Methods 0.000 description 3
- 244000144987 brood Species 0.000 description 3
- 238000005520 cutting process Methods 0.000 description 3
- 230000016396 cytokine production Effects 0.000 description 3
- 230000029087 digestion Effects 0.000 description 3
- 239000003814 drug Substances 0.000 description 3
- 239000000975 dye Substances 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 229960000310 isoleucine Drugs 0.000 description 3
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 229930182817 methionine Natural products 0.000 description 3
- 108091005601 modified peptides Proteins 0.000 description 3
- 239000000178 monomer Substances 0.000 description 3
- 230000001717 pathogenic effect Effects 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 235000018102 proteins Nutrition 0.000 description 3
- 102000004169 proteins and genes Human genes 0.000 description 3
- 239000011347 resin Substances 0.000 description 3
- 229920005989 resin Polymers 0.000 description 3
- 238000012216 screening Methods 0.000 description 3
- 230000004936 stimulating effect Effects 0.000 description 3
- 230000000638 stimulation Effects 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- BVAUMRCGVHUWOZ-ZETCQYMHSA-N (2s)-2-(cyclohexylazaniumyl)propanoate Chemical compound OC(=O)[C@H](C)NC1CCCCC1 BVAUMRCGVHUWOZ-ZETCQYMHSA-N 0.000 description 2
- XJODGRWDFZVTKW-LURJTMIESA-N (2s)-4-methyl-2-(methylamino)pentanoic acid Chemical compound CN[C@H](C(O)=O)CC(C)C XJODGRWDFZVTKW-LURJTMIESA-N 0.000 description 2
- XWHHYOYVRVGJJY-QMMMGPOBSA-N 4-fluoro-L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(F)C=C1 XWHHYOYVRVGJJY-QMMMGPOBSA-N 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- QNAYBMKLOCPYGJ-UHFFFAOYSA-N D-alpha-Ala Natural products CC([NH3+])C([O-])=O QNAYBMKLOCPYGJ-UHFFFAOYSA-N 0.000 description 2
- 102000011786 HLA-A Antigens Human genes 0.000 description 2
- 108010075704 HLA-A Antigens Proteins 0.000 description 2
- 108010002350 Interleukin-2 Proteins 0.000 description 2
- 102000000588 Interleukin-2 Human genes 0.000 description 2
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 2
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 102000007557 Melanoma-Specific Antigens Human genes 0.000 description 2
- 108010071463 Melanoma-Specific Antigens Proteins 0.000 description 2
- 125000001429 N-terminal alpha-amino-acid group Chemical group 0.000 description 2
- 241001597008 Nomeidae Species 0.000 description 2
- GEYBMYRBIABFTA-VIFPVBQESA-N O-methyl-L-tyrosine Chemical compound COC1=CC=C(C[C@H](N)C(O)=O)C=C1 GEYBMYRBIABFTA-VIFPVBQESA-N 0.000 description 2
- 102220467388 Otoancorin_Y48F_mutation Human genes 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- 229920000361 Poly(styrene)-block-poly(ethylene glycol) Polymers 0.000 description 2
- 206010060862 Prostate cancer Diseases 0.000 description 2
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 2
- 102220524355 Sortilin-related receptor_E44D_mutation Human genes 0.000 description 2
- 208000024313 Testicular Neoplasms Diseases 0.000 description 2
- 206010057644 Testis cancer Diseases 0.000 description 2
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 2
- 239000004473 Threonine Substances 0.000 description 2
- 102000003425 Tyrosinase Human genes 0.000 description 2
- 108060008724 Tyrosinase Proteins 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 229960003767 alanine Drugs 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 230000006399 behavior Effects 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 230000008512 biological response Effects 0.000 description 2
- 210000001185 bone marrow Anatomy 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 2
- 230000009089 cytolysis Effects 0.000 description 2
- 230000002950 deficient Effects 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000012636 effector Substances 0.000 description 2
- 206010014599 encephalitis Diseases 0.000 description 2
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 2
- 239000007850 fluorescent dye Substances 0.000 description 2
- MURGITYSBWUQTI-UHFFFAOYSA-N fluorescin Chemical compound OC(=O)C1=CC=CC=C1C1C2=CC=C(O)C=C2OC2=CC(O)=CC=C21 MURGITYSBWUQTI-UHFFFAOYSA-N 0.000 description 2
- 208000005017 glioblastoma Diseases 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 210000000987 immune system Anatomy 0.000 description 2
- 230000002998 immunogenetic effect Effects 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 239000000543 intermediate Substances 0.000 description 2
- 210000005210 lymphoid organ Anatomy 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- HVGQWHMSVYODLJ-GFCCVEGCSA-N melanochrome Natural products CC1(C)Oc2cc3OC(=CC(=O)c3c(O)c2C[C@H]1O)CO HVGQWHMSVYODLJ-GFCCVEGCSA-N 0.000 description 2
- 210000003574 melanophore Anatomy 0.000 description 2
- 239000003068 molecular probe Substances 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 210000001616 monocyte Anatomy 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 238000007639 printing Methods 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 230000010076 replication Effects 0.000 description 2
- 102220024629 rs267607615 Human genes 0.000 description 2
- 102200082814 rs33922842 Human genes 0.000 description 2
- FSYKKLYZXJSNPZ-UHFFFAOYSA-N sarcosine Chemical compound C[NH2+]CC([O-])=O FSYKKLYZXJSNPZ-UHFFFAOYSA-N 0.000 description 2
- 238000013515 script Methods 0.000 description 2
- 230000002269 spontaneous effect Effects 0.000 description 2
- 239000003351 stiffener Substances 0.000 description 2
- 230000002483 superagonistic effect Effects 0.000 description 2
- 206010042863 synovial sarcoma Diseases 0.000 description 2
- 238000010189 synthetic method Methods 0.000 description 2
- 201000003120 testicular cancer Diseases 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 238000002255 vaccination Methods 0.000 description 2
- 230000002792 vascular Effects 0.000 description 2
- VEEGZPWAAPPXRB-BJMVGYQFSA-N (3e)-3-(1h-imidazol-5-ylmethylidene)-1h-indol-2-one Chemical compound O=C1NC2=CC=CC=C2\C1=C/C1=CN=CN1 VEEGZPWAAPPXRB-BJMVGYQFSA-N 0.000 description 1
- POVNCJSPYFCWJR-USZUGGBUSA-N (4s)-4-[[(2s)-2-[[(2s)-2-amino-3-(4-hydroxyphenyl)propanoyl]amino]-4-methylpentanoyl]amino]-5-[(2s)-2-[[2-[(2s)-2-[[(2s)-1-[[(2s,3r)-1-[[(1s)-1-carboxy-2-methylpropyl]amino]-3-hydroxy-1-oxobutan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]carbamoyl]pyrrolidin-1- Chemical compound C([C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N1[C@@H](CCC1)C(=O)NCC(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O)C1=CC=C(O)C=C1 POVNCJSPYFCWJR-USZUGGBUSA-N 0.000 description 1
- KPYXMALABCDPGN-HYOZMBHHSA-N (4s)-5-[[(2s)-6-amino-1-[[(2s,3s)-1-[[(2s)-1-[[(2s)-1-[[(2s)-1-[[(2s)-1-[[(2r)-1-[[2-[[2-[[(1s)-3-amino-1-carboxy-3-oxopropyl]amino]-2-oxoethyl]amino]-2-oxoethyl]amino]-1-oxo-3-sulfanylpropan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-1-oxopropan-2-yl]a Chemical compound NC(=O)C[C@@H](C(O)=O)NC(=O)CNC(=O)CNC(=O)[C@H](CS)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN)CC1=CC=C(O)C=C1 KPYXMALABCDPGN-HYOZMBHHSA-N 0.000 description 1
- DSSYKIVIOFKYAU-XCBNKYQSSA-N (R)-camphor Chemical compound C1C[C@@]2(C)C(=O)C[C@@H]1C2(C)C DSSYKIVIOFKYAU-XCBNKYQSSA-N 0.000 description 1
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 108090001008 Avidin Proteins 0.000 description 1
- 102100035526 B melanoma antigen 1 Human genes 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 101150013553 CD40 gene Proteins 0.000 description 1
- 101100314454 Caenorhabditis elegans tra-1 gene Proteins 0.000 description 1
- 102000000584 Calmodulin Human genes 0.000 description 1
- 108010041952 Calmodulin Proteins 0.000 description 1
- 241000282836 Camelus dromedarius Species 0.000 description 1
- 102100025933 Cancer-associated gene 1 protein Human genes 0.000 description 1
- 206010057248 Cell death Diseases 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 241001146209 Curio rowleyanus Species 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- 108010041986 DNA Vaccines Proteins 0.000 description 1
- 238000001712 DNA sequencing Methods 0.000 description 1
- 229940021995 DNA vaccine Drugs 0.000 description 1
- 101100481408 Danio rerio tie2 gene Proteins 0.000 description 1
- 206010011968 Decreased immune responsiveness Diseases 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 1
- KRHYYFGTRYWZRS-UHFFFAOYSA-N Fluorane Chemical compound F KRHYYFGTRYWZRS-UHFFFAOYSA-N 0.000 description 1
- 102100025101 GATA-type zinc finger protein 1 Human genes 0.000 description 1
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 1
- 101000874316 Homo sapiens B melanoma antigen 1 Proteins 0.000 description 1
- 101000933825 Homo sapiens Cancer-associated gene 1 protein Proteins 0.000 description 1
- 101100137533 Homo sapiens PRAME gene Proteins 0.000 description 1
- 101001094545 Homo sapiens Retrotransposon-like protein 1 Proteins 0.000 description 1
- 101000851007 Homo sapiens Vascular endothelial growth factor receptor 2 Proteins 0.000 description 1
- 102100023915 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108090000978 Interleukin-4 Proteins 0.000 description 1
- 108010002586 Interleukin-7 Proteins 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- 125000000998 L-alanino group Chemical group [H]N([*])[C@](C([H])([H])[H])([H])C(=O)O[H] 0.000 description 1
- 150000008575 L-amino acids Chemical class 0.000 description 1
- UKAUYVFTDYCKQA-VKHMYHEASA-N L-homoserine Chemical compound OC(=O)[C@@H](N)CCO UKAUYVFTDYCKQA-VKHMYHEASA-N 0.000 description 1
- VAYOSLLFUXYJDT-RDTXWAMCSA-N Lysergic acid diethylamide Chemical class C1=CC(C=2[C@H](N(C)C[C@@H](C=2)C(=O)N(CC)CC)C2)=C3C2=CNC3=C1 VAYOSLLFUXYJDT-RDTXWAMCSA-N 0.000 description 1
- 102000016200 MART-1 Antigen Human genes 0.000 description 1
- 206010027336 Menstruation delayed Diseases 0.000 description 1
- 240000002769 Morchella esculenta Species 0.000 description 1
- 235000002779 Morchella esculenta Nutrition 0.000 description 1
- 101100481410 Mus musculus Tek gene Proteins 0.000 description 1
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 1
- 239000004677 Nylon Substances 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 108700020796 Oncogene Proteins 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- OGNKZWAQLJPNLL-STQMWFEESA-N Phe(4-NO2)-Gln Chemical compound NC(=O)CC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)C)CC1=CC=C([N+]([O-])=O)C=C1 OGNKZWAQLJPNLL-STQMWFEESA-N 0.000 description 1
- 101800001357 Potential peptide Proteins 0.000 description 1
- 102400000745 Potential peptide Human genes 0.000 description 1
- 101000702488 Rattus norvegicus High affinity cationic amino acid transporter 1 Proteins 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 1
- 108010077895 Sarcosine Proteins 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 239000005864 Sulphur Substances 0.000 description 1
- 230000006044 T cell activation Effects 0.000 description 1
- 108700019146 Transgenes Proteins 0.000 description 1
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- 239000003875 Wang resin Substances 0.000 description 1
- NERFNHBZJXXFGY-UHFFFAOYSA-N [4-[(4-methylphenyl)methoxy]phenyl]methanol Chemical compound C1=CC(C)=CC=C1COC1=CC=C(CO)C=C1 NERFNHBZJXXFGY-UHFFFAOYSA-N 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 229940124277 aminobutyric acid Drugs 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 238000004873 anchoring Methods 0.000 description 1
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 1
- 239000004037 angiogenesis inhibitor Substances 0.000 description 1
- 108010066173 baratin Proteins 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 230000003570 biosynthesizing effect Effects 0.000 description 1
- 230000001851 biosynthetic effect Effects 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 229960000846 camphor Drugs 0.000 description 1
- 238000009566 cancer vaccine Methods 0.000 description 1
- 229940022399 cancer vaccine Drugs 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 239000013592 cell lysate Substances 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 238000002648 combination therapy Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 230000001461 cytolytic effect Effects 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 238000013016 damping Methods 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 239000000032 diagnostic agent Substances 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 108010083141 dipeptidyl carboxypeptidase Proteins 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 230000007515 enzymatic degradation Effects 0.000 description 1
- 201000004101 esophageal cancer Diseases 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- BTCSSZJGUNDROE-UHFFFAOYSA-N gamma-aminobutyric acid Chemical compound NCCCC(O)=O BTCSSZJGUNDROE-UHFFFAOYSA-N 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 210000003917 human chromosome Anatomy 0.000 description 1
- 229910000040 hydrogen fluoride Inorganic materials 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 239000000367 immunologic factor Substances 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 229940121354 immunomodulator Drugs 0.000 description 1
- 230000002584 immunomodulator Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- XUWPJKDMEZSVTP-LTYMHZPRSA-N kalafungina Chemical compound O=C1C2=C(O)C=CC=C2C(=O)C2=C1[C@@H](C)O[C@H]1[C@@H]2OC(=O)C1 XUWPJKDMEZSVTP-LTYMHZPRSA-N 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000001840 matrix-assisted laser desorption--ionisation time-of-flight mass spectrometry Methods 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- 238000012737 microarray-based gene expression Methods 0.000 description 1
- 238000005497 microtitration Methods 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- PYLWMHQQBFSUBP-UHFFFAOYSA-N monofluorobenzene Chemical compound FC1=CC=CC=C1 PYLWMHQQBFSUBP-UHFFFAOYSA-N 0.000 description 1
- 238000012243 multiplex automated genomic engineering Methods 0.000 description 1
- 230000004719 natural immunity Effects 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 230000035764 nutrition Effects 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 229920001778 nylon Polymers 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 210000005259 peripheral blood Anatomy 0.000 description 1
- 239000011886 peripheral blood Substances 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 210000002381 plasma Anatomy 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 108010005636 polypeptide C Proteins 0.000 description 1
- 238000002203 pretreatment Methods 0.000 description 1
- 210000000064 prostate epithelial cell Anatomy 0.000 description 1
- 208000023958 prostate neoplasm Diseases 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000003362 replicative effect Effects 0.000 description 1
- 238000012827 research and development Methods 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 230000000630 rising effect Effects 0.000 description 1
- 102220011342 rs1063385 Human genes 0.000 description 1
- 102220104277 rs879254200 Human genes 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 229940043230 sarcosine Drugs 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 238000012549 training Methods 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 102000035160 transmembrane proteins Human genes 0.000 description 1
- 108091005703 transmembrane proteins Proteins 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 230000002477 vacuolizing effect Effects 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4748—Tumour specific antigens; Tumour rejection antigen precursors [TRAP], e.g. MAGE
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0008—Antigens related to auto-immune diseases; Preparations to induce self-tolerance
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/06—Linear peptides containing only normal peptide links having 5 to 11 amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K2035/122—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells for inducing tolerance or supression of immune responses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/53—DNA (RNA) vaccination
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/64—Medicinal preparations containing antigens or antibodies characterised by the architecture of the carrier-antigen complex, e.g. repetition of carrier-antigen units
- A61K2039/645—Dendrimers; Multiple antigen peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
Abstract
一些实施方案涉及与I类MHC-限制性T细胞表位相对应的肽的类似物以及产生它们的方法。这些类似物可以含有在直接与MHC分子相互作用的残基的氨基酸取代,并且可以赋予提高的、改进的或有用的免疫学特性。另外,本发明公开了各种类似物,其中各种取代包括非标准残基正亮氨酸和/或正缬氨酸。
Description
相关申请的交叉参考
本申请要求于2005年6月17日提交的美国临时专利申请序列号.60/691,889的提交日期的利益,其无放弃地完全结合于此作为参考。
发明背景
发明领域
在某些实施方案中,本文所公开的发明涉及与I类MHC限制性T细胞表位相对应的肽的类似物,和用于它们的产生的方法。这些类似物可以含有在直接与MHC分子相互作用的残基上的氨基酸取代,并且可以赋予提高的、改善的或有用的免疫特性。特别地,鉴定了来自肿瘤相关的抗原SSX-2、NY-ESO-1、PRAME、PSMA、酪氨酸酶、和melan-A的表位类似物。另外,公开了类似物的种类,其中各种取代包括非标准的残基正亮氨酸和/或正缬氨酸。
相关技术的描述
主要组织相容性复合体与T细胞靶点识别
T淋巴细胞(T细胞)是在应答具体的抗原信号中起作用的抗原-特异性免疫细胞。B淋巴细胞和它们产生的抗体也是抗原-特异性的实体。然而,与B淋巴细胞不同,T细胞不应答游离的或溶解形式的抗原。对于T细胞应答抗原,它需要所述抗原结合到包含主要组织相容性复合体(MHC)蛋白的呈递复合体上。
MHC蛋白提供T细胞区分本有的或“自身”细胞与外来细胞的方式。MHC分子是一类免疫受体,其呈递随后要受到T细胞监测的潜在的肽表位。存在2种类型的MHC,I类MHC和II类MHC。CD4+T细胞与II类MHC蛋白相互作用,并且主要具有辅助表型,而CD8+T细胞与I类MHC蛋白相互作用,并且主要具有细胞溶解表型,但是它们每一种还可以表现出调控功能,特别是抑制性的功能。I类和II类两类MHC都是跨膜蛋白,它们的大部分结构位于细胞的外表面。另外,两类MHC都在它们的外侧部分具有肽结合裂口。就是在这一裂口,将小片段蛋白,内在的或外来的,结合并且呈递到细胞外环境。
称为抗原呈递细胞(APCs)的细胞应用MHC将抗原展示给T细胞。T细胞可以识别抗原,如果所述抗原是存在于MHC上的话。这种需要叫作MHC限制性。如果抗原不是由可识别的MHC所展示,所述T细胞将不识别和作用于所述抗原信号。对结合到可识别的MHC上的肽特异性的T细胞结合到这些MHC-肽复合体上,并且进行免疫应答下面的阶段.
发明概述
SSX-2
41-49
类似物实施方案
实施方案包括I类MHC-限制性T细胞表位SSX-241-49的类似物,KASEKIFYV(SEQ ID NO.1),包括这些类似物的多肽(其可以由pAPC加工以呈递所述表位类似物),和表达所述类似物的核酸。与野生型表位相比较,所述类似物可以具有相似的或提高的免疫特性。
一个特别的实施方案涉及一种分离的SSX-2肽,其具有包括序列KASEKIFYV(SEQ ID NO.1)的一个或多个氨基酸取代的序列,所述SSX-2肽以充分的量存在,足以激发从由针对具有序列KASEKIFYV(SEQID NO:1)的表位的免疫而产生的T细胞系产生细胞因子。一方面,所述充分的量小于10μM。另一方面,所述量小于3μM。另一方面,所述量小于1μM。一方面,所述一个或多个氨基酸取代可以包括至少一个标准的氨基酸取代。当用于本文时,“标准氨基酸”包括20种遗传编码的氨基酸中的任一种。因此,一方面,例如,所述至少一个标准氨基酸取代可以为Tyr、Val、Leu、Ala、Ile、Met、Trp、Phe、Asp、Asn或Ser。另一方面,所述一个或多个氨基酸取代可以包括至少一个非标准的氨基酸取代。所述非标准的氨基酸包括,例如,但不限于,下列各项中的任一种:正亮氨酸(Nle),正缬氨酸(Nva),苯基甘氨酸(Phg),4-氟苯丙氨酸(Phe(4-F)),4-硝基苯丙氨酸(Phe(4-NO2)),α-氨基丁酸(Abu),α-氨基异丁酸(Aib),甲基-亮氨酸(MeLeu),甲基缬氨酸(MeVal),β-(3-苯并噻吩基)-丙氨酸(β-(3-苯并噻吩基)Ala),O-甲基酪氨酸(O-methyltyorosine)(O-甲基-Tyr),环己基丙氨酸(Cha),β-(1-萘基)-丙氨酸(Nal-1),β-(2-萘基)-丙氨酸(Nal-2),标准氨基酸的D-立体异构体,或其中羧基末端已被修饰成酰胺(显示为-NH2)的氨基酸。因此,在一个方面,所述至少一个非标准氨基酸取代可以是Nle、Nva、Abu、或标准氨基酸的D-立体异构体。另一方面,所述一个或多个氨基酸取代可以包括修饰的末端氨基酸。一方面,所述修饰的末端氨基酸可以是酰胺化的C端氨基酸。另一方面,至少一种取代可以是氨基酸的添加,其中所述添加是C端添加。另一方面,肽还可以包括在任何位点的保守氨基酸的取代,但是优选地在不明显参与任何MHC相互作用的P3、P5或P7位点。
另一个实施方案涉及9个氨基酸P1-P9的分离的肽,其可以在每个位点包括一个氨基酸。例如,P1可以是K、F、Y、W、Phg、Phe(4-F)、Phe(4-NO2)、MeTyr、β-(3-苯并噻吩基)-Ala、或D-Lys;P2可以是A、L、V、I、M、D-Ala、Nal-2、Abu、Aib、Nle或Nva;P3可以是S;P4可以是E、Q、Nle、或Nva;P5可以是K;P6可以是I、L、V、Nle或Nva;P7可以是F;P8可以是Y、F、Phe(4-F);和在P9的PΩ(P-Ω)可以是V、I、A、Nva、MeVal、或Abu。在一些实例中,所述序列不是KASEKIFYV(SEQ ID NO.1)。
另一个实施方案涉及一种9个氨基酸P1-P9的分离肽,其可以在每个位点包括一个氨基酸。例如,P1可以是K、F、Y、W、Phg、Phe(4-F)、Phe(4-NO2)、MeTyr、β-(3-苯并噻吩基)-Ala、或D-Lys;P2可以是V、L、M、Abu、Nle或Nva;P3可以是S;P4可以是E、Q、Nle、或Nva;P5可以是K;P6可以是I、L、V、Nle或Nva;P7可以是F;P8可以是Y、F、Phe(4-F);和在P9的PΩ可以是V、I、A、Nva、MeVal、Abu或V-NH2。
另一个实施方案涉及一种9个氨基酸P1-P9的分离肽,其可以在每个位点包括一个氨基酸。例如,P1可以是K、F、Y、W、Phg、Phe(4-F)、Phe(4-NO2)、MeTyr、β-(3-苯并噻吩基)-Ala、或D-Lys;P2可以是A、L、V、M、Abu、Nle或Nva;P3可以是S;P4可以是E、Q、Nle、或NvaP5可以是K;P6可以是I、L、V、Nle或Nva;P7可以是F;P8可以是Y、F、Phe(4-F);P9可以是V;和在P10的PΩ可以是I或L。
另一个实施方案涉及一种9个氨基酸P1-P9的分离肽,其可以在每个位点包括一个氨基酸。例如,P1可以是K、F、Y、W、Phg、Phe(4-F)、Phe(4-NO2)、MeTyr、β-(3-苯并噻吩基)-Ala、或D-Lys;P2可以是V;P3可以是S;P4可以是E、Q、Nle、或Nva;P5可以是K;P6可以是I、L、V、Nle或Nva;P7可以是F;P8可以是Y、F、Phe(4-F);P9可以是V;和在P10的PΩ可以是I、L、V、或Nle。
另一个实施方案涉及一种9个氨基酸P1-P9的分离肽,其可以在每个位点包括一个氨基酸。例如,P1可以是K、F、Y、W、Phg、Phe(4-F)、Phe(4-NO2)、MeTyr、β-(3-苯并噻吩基)-Ala、或D-Lys;P2可以是L;P3可以是S;P4可以是E、Q、Nle、或Nva;P5可以是K;P6可以是I、L、V、Nle或Nva;P7可以是F;P8可以是Y、F、Phe(4-F);P9可以是V;和在P10的PΩ可以是I、L、V、Nle或Nva。
另一个实施方案涉及具有下述序列的分离肽:K{L,V,M,I,D-Ala,D-Val,Nal-2,Aib,Abu,Nle,或Nva}SEKIFYV(SEQ ID NO.2);或{F,Phg,Y,Phe(4-F),Phe(4-NO2),O-甲基-Tyr,或β-(3-苯并噻吩基)-Ala}ASEKIFYV(SEQ ID NO.3);或{Y,F,或W}{V,M,或I}SEKIFYV(SEQ ID NO.4);或{F或W}LSEKIFYV(SEQ ID NO.5);或K{A,V,或L}SEKIFYI(SEQID NO.6);或K{L或V}SEKIFYV-NH2(SEQ ID NO.7);或FVSEKIFY{I,A,Nva,Abu,或MeVal}(SEQ ID NO.8);或FVS{Q,Nle,或Nva}KIFYV(SEQ ID NO.9);或FVSEK{L,V,Nle,或Nva}FYV(SEQ ID NO.10);或FVSEKIF{F或Phe(4-F)}V(SEQ ID NO.11);或KASEKIFYV{I或L}(SEQID NO.12);或KVSEKIFYV{I,L,V,或Nle}(SEQ ID NO.13);或KLSEKIFYV{L,V,Nle,或Nva}(SEQ ID NO.14)。
另一个实施方案涉及具有下述序列的分离肽:K{L,V,M,Abu,Nle,或Nva}SEKIFYV(SEQ ID NO.15);或{F或Phg}A SEKIFYV(SEQ ID NO.16);或YVSEKIFYV(SEQ ID NO.17);或F{L,V,或I}SEKIFYV(SEQ IDNO.18);或W{L或I}SEKIFYV(SEQ ID NO.19);或K{V或L}SEKIFYI(SEQ ID NO.20);或FVSEKIFY{I或Nva}(SEQ ID NO.21)。
另一个实施方案涉及具有下述序列的分离肽:K{V或L}SEKIFYV(SEQ ID NO.22);或{F或Y}ASEKIFYV(SEQ ID NO.23);或FVSEKIFYI(SEQ ID NO.24)。
另一个实施方案涉及I类MHC/肽复合体,其中所述肽具有在上文和本文的其它地方所描述的实施方案中的任何一种肽的序列。一方面,所述复合体可以与识别I类MHC/SSX-241-49复合体的T细胞受体(TCR)交叉反应。另一方面,所述复合体可以是HLA-A2/SSX-241-49复合体。
另一个实施方案涉及一种免疫原性组合物,其可以包括上文和本文的其它地方所描述的肽实施方案中的任一种。一方面,所述肽可以具有,例如,下述序列:K{L,V,M,Abu,Nle,或Nva}SEKIFYV(SEQ ID NO.15);或{F或Phg}A SEKIFYV(SEQ ID NO.16);或YVSEKIFYV(SEQ ID NO.17);或F{L,V,或I}SEKIFYV(SEQ ID NO.18);或W{L或I}SEKIFYV(SEQ ID NO.19);或K{V或L}SEKIFYI(SEQ ID NO.20);或FVSEKIFY{I或Nva}(SEQ ID NO.21),或K{V或L}SEKIFYV(SEQ IDNO.22);或{F或Y}ASEKIFYV(SEQ ID NO.23);或FVSEKIFYI(SEQ IDNO.24)。
一些其它的实施方案涉及I类MHC限制性T细胞表位NY-ESO-1157-165,SLLMWITQC(SEQ ID NO.25)的类似物,包含这些类似物的多肽,以及表达所述类似物的核酸,所述多肽可以由pAPC处理以呈递所述表位类似物。与野生型表位相比较,所述类似物可以具有相似的或提高的免疫特性。
一个实施方案涉及分离的NY-ESO-1157-165肽,其具有包括序列SLLMWITQC(SEQ ID NO.25)的一个或多个氨基酸取代的序列,所述NY-ESO-1157-165肽以充分的量存在,足以激发从由针对具有序列SLLMWITQC(SEQ ID NO.25)的表位的免疫而产生的T细胞系产生细胞因子。例如,一方面,所述充分的量可以小于10μM。另一方面,所述量可以小于3μM。此外,另一方面,所述量可以小于1μM。另一方面,所述量小于0.3μM。一方面,所述一个或多个氨基酸取代可以包括至少一个标准的氨基酸。另一方面,所述一个或多个氨基酸取代可以包括至少一个非标准的氨基酸。另一方面,所述一个或多个氨基酸取代可以包括修饰的末端氨基酸。一方面,所述修饰的末端氨基酸可以是酰胺化的C-端氨基酸。在另一方面,至少一种取代可以是氨基酸的添加,其中所述添加是C端添加。
一个实施方案涉及一种具有这样的序列的分离肽,其中:
P1是S,F,K,或W;
P2是L,I,V,Nle,或Nva;
P3是L;
P4是M,L,或N;
P5是W;
P6是I,A,L,V,或N;
P7是T;
P8是Q,E,D,或T;
在P9的PΩ是C,V,I,L,A,Nva,Nle,V-NH2,或L-NH2;并且
其中所述序列不是SLLMWITQ{C,V,I,L,或A}(SEQ ID NO.26),FVLMWITQA(SEQ ID NO.27),或FILMWITQ{L或I}(SEQ ID NO.28)。
另一实施方案涉及具有这样的序列的分离肽,其中:
P1是Y;
P2是L,V,I,Nle,或Nva;
P3是L;
P4是M,L,或N;
P5是W;
P6是I,A,L,V,或N;
P7是T;
P8是Q,E,D,或T;
在P9的PΩ是V,I,L,Nva,Nle,V-NH2,或L-NH2;并且
其中所述序列不是YVLMWITL(SEQ ID NO.29)或YLLMWIT{I或L}(SEQ ID NO.30)。
另一个实施方案涉及一种分离的十聚体肽,其具有序列{S或Y}LLMWITQ{C或V}{L,I或Nle}(SEQ ID NO.31)。
另一个实施方案涉及一种分离的肽,其具有序列SILMWITQ{C,V,L,或A}(SEQ ID NO.32),YLLMWITQ{Nva或Nle}(SEQ ID NO.33),F{L或V}LMWITQ{V,L,或I}(SEQ ID NO.34),Y{I,Nva,或Nle}LMWITQV(SEQ ID NO.35),YLLLWITQV(SEQ ID NO.36),或TVLMWITQV(SEQID NO.37)。
另一个实施方案涉及一种分离肽,其具有序列{S或F}VLMWITQV(SEQ ID NO.38),SLMWITQNva(SEQ ID NO.39),或SNvaLMWITQV(SEQ ID NO.40)。
另一个实施方案涉及一种具有序列SNvaLMWITQV(SEQ ID NO.40)的分离肽。
一些实施方案涉及一种分离肽。所述肽可以包括这样的序列或基本上由其组成,其中:
P0是X,XX,或XXX,其中X指定任何氨基酸或无氨基酸;和
P1是K,F,Y,W,Phg,Phe(4-F),Phe(4-NO2),MeTyr,β-(3-苯并噻吩基)-Ala,或D-Lys;和
P2是A,L,V,I,M,D-Ala,Nal-2,Abu,Aib,Nle,或Nva;和
P3是S;和
P4是E,Q,Nle,或Nva;和
P5是K;和
P6是I,L,V,Nle,或Nva;和
P7是F;和
P8是Y,F,Phe(4-F);和
在P9的PΩ是V,I,A,Nva,MeVal,Abu,或V-NH2,或P9是V,并且在P10的PΩ是I,L,V,Nle或Nva;和
PΩ+1是X,XX,或XXX,其中X指定任何氨基酸或没有氨基酸;并且
其中所述序列不是KASEKIFYV(SEQ ID NO.1);
所述分离肽可以包括下述序列或基本上由下述序列组成:
K{L,V,M,I,D-Ala,D-Val,Nal-2,Aib,Abu,Nle,或Nva}SEKIFYV(SEQ ID NO.2);或
{F,Phg,Y,Phe(4-F),Phe(4-NO2),O-甲基-Tyr,或β-(3-苯并噻吩基-Ala}ASEKIFYV(SEQ ID NO.3);或
{Y,F,或W}{V,M,或I}SEKIFYV(SEQ ID NO.4);或
{F或W}LSEKIFYV(SEQ ID NO.5);或
K{A,V,或L}SEKIFYI(SEQ ID NO.6);或
K{L或V}SEKIFYV-NH2(SEQ ID NO.7);或
FVSEKIFY{I,A,Nva,Abu,或MeVal}(SEQ ID NO.8);或
FVS{Q,Nle,或Nva}KIFYV(SEQ ID NO.9);或
FVSEK{L,V,Nle,或Nva}FYV(SEQ ID NO.10);或
FVSEKIF{F或Phe(4-F)}V(SEQ ID NO.11);或
KASEKIFYV{I或L}(SEQ ID NO.12);或
KVSEKIFYV{I,L,V,或Nle}(SEQ ID NO.13);或
KLSEKIFYV{L,V,Nle,或Nva}(SEQ ID NO.14)。
所述分离肽可以包括下述序列或基本上由下述序列组成:
K{L,V,M,Abu,Nle,或Nva}SEKIFYV(SEQ ID NO.15);或
{F或Phg}A SEKIFYV(SEQ ID NO.16);或
YVSEKIFYV(SEQ ID NO.17);或
F{L,V,或I}SEKIFYV(SEQ ID NO.18);或
W{L或I}SEKIFYV(SEQ ID NO.19);或
K{V或L}SEKIFYI(SEQ ID NO.20);或
FVSEKIFY{I或Nva}(SEQ ID NO.21)。
此外,所述分离肽可以包括下述序列或基本上由下述序列组成:
K{V或L}SEKIFYV(SEQ ID NO.22);或
{F或Y}ASEKIFYV(SEQ ID NO.23);或
FVSEKIFYI(SEQ ID NO.24);或
KVSEKIFYV(SEQ ID NO.41)。
此外,所述分离肽可以包括或基本上由序列KVSEKIFYV(SEQ IDNO.41)组成。
所述分离肽可以具有对于I类MHC肽结合裂口的亲和力。所述MHC可以是,例如,HLA-A2。
一些实施方案涉及I类MHC/肽复合体,其中所述肽可以具有上文或本文其它地方所述的任一种肽的序列。所述I类MHC/肽复合体可以与识别I类MHC/SSX-241-49复合体的TCR交叉反应。所述I类MHC/肽复合体可以是HLA-A2/S8X-241-49复合体。
其它实施方案涉及一种包括如上文和本文其它地方所述的肽的多肽,其包埋在释放序列(liberation sequence)内部。
另一实施方案涉及免疫原性组合物,其包括如上文或本文其它地方所述的肽。
其它实施方案涉及编码或者用于表达如上文或本文其它地方所述的多肽的核酸或核酸工具(means)。并且,一些实施方案涉及包括这样的核酸或核酸工具的免疫原性组合物。
一些实施方案涉及诱导、维持、或增强CTL应答的方法。所述方法可以包括结节内施用如上文和本文其它地方所述的组合物。
其它实施方案涉及引发(entraining)I类MHC限制性T细胞应答的方法,所述方法可以包括结节内施用如上文或本文其它地方所述的组合物。所述方法还可以包括免疫强化剂的施用。
其它实施方案涉及诱导、维持、或引发CTL应答的方法,所述方法可以包括结节内施用如上文和本文其它地方所述的组合物。
一些实施方案涉及包括在序列KASEKIFYV(SEQ ID NO.1)中有1-3个氨基酸取代的分离肽,其具有对于I类MHC结合裂口的亲和力,所述亲和力相似于或大于KASEKIFYV(SEQ ID NO.1)对于所述I类MHC结合裂口的亲和力。解离半衰期可以相似于或大于KASEKIFYV(SEQ IDNO.1)对于所述I类MHC结合裂口的解离半衰期。所述分离肽可以被具有对肽KASEKIFYV(SEQ ID NO.1)的特异性的T细胞识别。
其它实施方案涉及包括或基本上由下述序列组成的分离肽,其中:
P1是K,F,Y,W,Phg,Phe(4-F),Phe(4-NO2),MeTyr,β-(3-苯并噻吩基)-Ala,或D-Lys;和
P2是A,L,V,I,M,D-Ala,Nal-2,Abu,Aib,Nle,或Nva;和
P3是S;和
P4是E,Q,Nle,或Nva;和
P5是K;和
P6是I,L,V,Nle,或Nva;和
P7是F;和
P8是Y,F,Phe(4-F);和
在P9的PΩ是V,I,A,Nva,MeVal,或Abu;
其中所述序列不是KASEKIFYV(SEQ ID NO.1);
或
P1是K,F,Y,W,Phg,Phe(4-F),Phe(4-NO2),MeTyr,β-(3-苯并噻吩基)-Ala,或D-Lys;和
P2是V,L,M,Abu,Nle,或Nva;和
P3是S;和
P4是E,Q,Nle,或Nva;和
P5是K;和
P6是I,L,V,Nle,或Nva;和
P7是F;和
P8是Y,F,Phe(4-F);和
在P9的PΩ是V,I,A,Nva,MeVal,Abu,或V-NH2;
或
P1是K,F,Y,W,Phg,Phe(4-F),Phe(4-NO2),MeTyr,β-(3-苯并噻吩基)-Ala,或D-Lys;和
P2是A,L,V,M,Abu,Nle,或Nva;和
P3是S;和
P4是E,Q,Nle,或Nva;和
P5是K;和
P6是I,L,V,Nle,或Nva;和
P7是F;和
P8是Y,F,Phe(4-F);和
P9是V;和
在P10的PΩ是I或L;
或
P1是K,F,Y,W,Phg,Phe(4-F),Phe(4-NO2),MeTyr,β-(3-苯并噻吩基)-Ala,或D-Lys;和
P2是V;和
P3是S;和
P4是E,Q,Nle,或Nva;和
P5是K;和
P6是I,L,V,Nle,或Nva;和
P7是F;和
P8是Y,F,Phe(4-F);和
P9是V;和
在P10的PΩ是I,L,V,或Nle;
或
P1是K,F,Y,W,Phg,Phe(4-F),Phe(4-NO2),MeTyr,β-(3-苯并噻吩基)-Ala,或D-Lys;和
P2是L;和
P3是S;和
P4是E,Q,Nle,或Nva;和
P5是K;和
P6是I,L,V,Nle,或Nva;和
P7是F;和
P8是Y,F,Phe(4-F);和
P9是V;和
在P10的PΩ是I,L,V,Nle或Nva。
一些实施方案涉及包括或基本上由这样的序列组成的分离肽,其中:
P0是X,XX或XXX,其中X指定任何氨基酸或没有氨基酸;和
P1是S,F,K,W或Y;和
P2是L,I,V,Nle,或Nva;和
P3是L;和
P4是M,L,或N;和
P5是W;和
P6是I,A,L,V,或N;和
P7是T;和
P8是Q,E,D,或T;和
在P9的PΩ是C,V,I,L,A,Nva,Nle,V-NH2,或L-NH2;和
PΩ+1是X,XX,XXX,其中X指定为任何氨基酸或没有氨基酸;并且
其中所述序列不是SLLMWITQ{C,V,I,L,或A}(SEQ ID NO.26),FVLMWITQA(SEQ ID NO.27),FILMWITQ{L或I}(SEQ ID NO.28),YVLMWITL(SEQ ID NO.29)或YLLMWIT{I或L}(SEQ ID NO.30)。
P1是S,F,K,或W;
P2是L,I,V,Nle,或Nva;
P3是L;
P4是M,L,或N;
P5是W;
P6是I,A,L,V,或N;
P7是T;
P8是Q,E,D,或T;
在P9的PΩ是C,V,I,L,A,Nva,Nle,V-NH2,或L-NH2;并且
其中所述序列不是SLLMWITQ{C,V,I,L,或A}(SEQ ID NO.26),FVLMWITQA(SEQ ID NO.27),或FILMWITQ{L或I}(SEQ ID NO.28);
或
P1是Y;
P2是L,V,I,Nle,或Nva;
P3是L;
P4是M,L,或N;
P5是W;
P6是I,A,L,V,或N;
P7是T;
P8是Q,E,D,或T;
在P9的PΩ是V,I,L,Nva,Nle,V,V-NH2,或L-NH2;并且
其中所述序列不是YVLMWITL(SEQ ID NO.29)或YLLMWIT{I或L}(SEQ ID NO.30)。
另一实施方案涉及I类MHC/肽复合体,其中所述肽可以具有上文或本文其它地方所述的实施方案中的任何肽的序列。一方面,所述复合体可以与识别I类MHC/NY-ESO-1157-165复合体的TCR交叉反应。另一方面,所述复合体可以是HLA-A2/NY-ESO-1157-165复合体。
在上述实施方案的一个方面中,所述肽可以具有对于I类MHC肽结合裂口,诸如HLA-A2的亲和力。
另一个实施方案涉及一种与释放序列缔合的多肽,其包括本文所述的任何实施方案的肽序列。
另一个实施方案涉及包括本文所述的任何肽实施方案的免疫原性组合物。一方面,所述肽可以具有如本文所列出的序列。
另一个实施方案涉及编码本文所述的任何肽实施方案的核酸,但是优选地是那些没有非标准氨基酸取代的核酸。在另一个方面,所述核酸可以编码在载体内。
另一个实施方案涉及包括编码本文所公开的任何肽实施方案的核酸的免疫原性组合物。
另一个实施方案涉及诱导CTL应答的方法,其包括结节内施用本文所公开的实施方案的任何组合物或肽。在另一个方面,所述方法可以允许维持CTL应答。在另一个方面,所述方法可以允许增强I类MHC限制性T细胞应答。在另一个方面,所述方法可以允许引发I类MHC限制性T细胞应答。在另一个方面,所述方法还可以包括施用免疫强化剂。
一些实施方案涉及具有包括天然表位序列中1-3或4个氨基酸取代的序列的分离肽,其中激发从通过针对具有所述序列的表位免疫而产生的T细胞系产生细胞因子所需要的所述肽的浓度不大于具体的浓度,例如,10μM,1μM,0.3μM,等。所述1-3或4个氨基酸取代可以包括至少一个标准氨基酸取代和/或至少一个非标准氨基酸取代,等等。所述至少一个非标准氨基酸可以是本文所述的那些中的任一种,例如,标准氨基酸的D-立体异构体,Nva,或Nle。所述1-3或4个氨基酸取代可以包括修饰的末端氨基酸,并且所述修饰的末端氨基酸可以是酰胺化的C末端氨基酸。一种取代可以是氨基酸的添加,例如,所述添加可以是C末端添加。
其它实施方案涉及具有某种氨基酸序列的肽,所述氨基酸序列包括与靶点相关抗原片段序列的至少一种差异,所述片段具有已知的或预测的对于MHC蛋白的肽结合裂口的亲和力,其中所述至少一种差异可以是取代位于所述片段中MHC结合基序锚定位置的残基的Nle或Nva。所述锚定位置可以是初级锚定位置,例如,P2或PΩ。所述锚定位置可以是辅助性锚定位置。所述差异可以包括取代所述片段中的疏水性残基的Nle或Nva残基。在一些方面中,I,L,或V可以是MHC结合基序锚定位置中的优选的残基。一些方面中,所述肽可以具有约8-约14个氨基酸的长度,或者更优选地,例如,9-10个氨基酸的长度。
所述MHC蛋白可以是人MHC蛋白,例如,I类HLA蛋白。所述MHC蛋白可以是,例如,诸如HLA-A2,A3,A24,A30,A66,A68,A69,B7,B8,B15,B27,B35,B37,B38,B39,B40,B48,B51,B52,B53,B 60,B61,B62,B63,B67,B70,B71,B75,B77,C4,Cw1,Cw3,Cw4,Cw6,Cw7,和Cw10的类型。在一些方面中,所述MHC蛋白可以是HLA-A2或A24。MHC可以具有锚定残基结合口袋,其中所述口袋是与HLA-A*0201的B-或F-口袋同源的。负责形成结合口袋,并且所述结合口袋容纳表位锚定残基并且由此确定MHC分子的结合特异性的所述MHC残基,在本领域内是充分理解的。这样的信息的一种汇编可以在FIMM(功能免疫学)网址以超文本转移链接(http://)″sdmc.lit.org.sg:8080/fimm/.″找到。(也可以参见C.,Koh J.L,Y.,Sheng X.,Wong L.,和V.Brusic.FIMM,功能分子免疫学数据库。Nucleic Acids Research(核酸研究),2000.卷28.No.1222-224;C.,Koh JL,Flower DR,Wong L.,和Brusic V.FIMM,功能分子免疫学数据库;2002更新,Nucleic Acids Research(核酸研究),2002.卷30.No.1226-229;以及Zhang,C.等,J.Mol.Biol.(分子生物学杂志)281:929-947,1998;它们中的每一个通过参考完全并入本申请中)。并且,所述肽可以具有至少一种结合特征,所述结合特征基本上等同于,或好于所述片段对于所述MHC的相应的特征。例如,与所述片段相比较,所述结合特征可以是提高的。例如,在一些实施方案中,所述结合特征可以是结合的亲和力或稳定性。
所述肽可以具有基本上等同于,或好于所述片段的免疫原性的免疫原性。所述免疫原性可以被增加。所述免疫原性可以引发与所述片段交叉反应的免疫应答,或者可以引发CTL应答。所述免疫原性可以得到评估,例如,应用通过测定识别所述肽的免疫应答,通过测定识别所述片段的免疫应答的MHC-四聚体检测,细胞因子检测,细胞毒性检测,应用体外免疫系统,或任何其它适宜的方法。所述免疫系统可以包括人细胞。所述免疫原性可以应用体内免疫系统进行评估,例如,包括转基因小鼠的免疫系统。所述肽可以具有如所述片段对于所述MHC的至少相似的结合特征。例如,在一些方面中,基于本公开内容,可以确定认为什么是“相似的”。在一些具体的方面,“相似性”可以基于,例如,用于半最大结合的肽浓度,相对亲和力,稳定性(一半解离时间)和交叉反应性/功能亲和力(avidity)。作为实例,如果它具有在天然肽的值的2倍、甚至是3倍、4倍、5倍或10倍内的结果或特征,那么可以认为肽是相似的。例如,对于交叉反应性/功能亲和力,相似的结果可以是这样的,即,其中所述数据在天然肽的3和10倍之内。作为另一个实例,当在天然肽的2,3,4,5,6,7,10,15或20%之内时,可以认为结合值的百分比是相似的。在一些方面中,当在天然序列的2或3倍之内时,可以认为ED50值是相似的。例如,相似的半解离时间可以在2或3倍之内。作为另一个实例,同野生型约有2倍不同的交叉反应性值可以认为是相似的。这些相似的值仅是示例性的,并且在一些实施方案的一些方面的内容中给出。基于本文的实验和教导,可以确定其它“相似的”值。
所述肽可以与所述片段免疫性交叉反应。因此,所述交叉反应性可以通过用所述片段免疫和评估所述肽的识别而进行评估。备选地,所述交叉反应性可以通过用所述肽进行免疫和评估所述片段的识别而进行评估。
例如,可以对上文和本文其它地方所述的肽进行修饰以包括两种差异。在一些实例中,每种差异可以独立地包括Nle或Nva残基。在一些实例中,一种差异可以不是Nle或Nva取代。并且,上文和本文其它地方所述的肽可以包括3种或更多的差异。
所述靶点-相关的抗原可以是肿瘤-相关抗原。所述靶点-相关的抗原可以是病原体-相关的抗原。
其它实施方案涉及包括如上述和本文其它地方描述的本发明肽的免疫原性组合物。其它实施方案涉及免疫方法,其包括给哺乳动物施用这样的组合物,例如,直接施用到哺乳动物的淋巴系统。
其它实施方案涉及制备T细胞表位类似物的方法。所述方法可以包括提供靶点-相关抗原的片段的氨基酸序列,所述片段可以具有已知的或预测的对于MHC蛋白的肽结合裂口的亲和力;将与MHC结合基序的锚定位置相对应的序列的至少一个氨基酸改变成Nle或Nva;并且合成包含所改变的序列的肽。例如,所述合成可以是化学合成或任何其它的合成方法。
一些实施方案涉及T细胞表位肽类似物,其中所述类似物不同于天然表位肽,其通过用Nle或Nva残基置换与MHC结合基序的锚定位置相对应的至少一个天然残基而实现。
一些实施方案涉及包括或基本上由这样的序列组成的分离肽,其中:
P0是X,XX或XXX,其中X指定任何氨基酸或没有氨基酸;和
P1是G,A,S,Abu或Sar;和
P2是L,M,I,Q,V,Nva,Nle,或Abu;和
P3是P或W;和
P4是S;和
P5是I;和
P6是P;和
P7是V;和
P8是H;和
P9是P,A,L,S或T;和
在P10的PΩ是I,L,V,Nva,或Nle;和
PΩ+1是X,XX,或XXX,其中X指定为任何氨基酸或没有氨基酸;并且
其中所述序列不是GLPSIPVHPI(SEQ ID NO.42)。
所述分离肽可以包含或基本上由下述序列组成:
{S,Sar,或Abu}LPSIPVHPI(SEQ ID NO.43);或
G{M或Nle}PSIPVHPI(SEQ ID NO.44);或
G{L,I,Nva,或Nle}WSIPVHPI(SEQ ID NO.45);或
GLWSIPVHP{Nva或V}(SEQ ID NO.46);或
GLPSIPVH{A或S}I(SEQ ID NO.47);或
GLPSIPVHP{V,L,Nva,或Nle}(SEQ ID NO.48);或
G{Nle}PSIPVHP{Nva,或Nle)(SEQ ID NO.49);或
G{Nva)PSIPVHP{Nva}(SEQ ID NO.50);或
G{V,Nva,或Nle}PSIPVHPV(SEQ ID NO.51);或
{Sar或Abu}LPSIPVHP{V或Nva}(SEQ ID NO.52);或
A{V,I,Nva,或Nle}WSIPVHPI(SEQ ID NO.53);或
AVPSIPVHP{V或Nva)(SEQ ID NO.54);或
A{Nva}PSIPVHPV(SEQ ID NO.55);或
ALWSIPVHP{V或Nva)(SEQ ID NO.56);或
GVWSIPVHP{V或Nva}(SEQ ID NO.57);或
G{Nva}WSIPVHPV(SEQ ID NO.58)。
此外,所述分离肽可以包含或基本上由下述序列组成:
{Abu}LPSIPVHPI(SEQ ID NO.59);或
G{V,Nva,或Abu}PSIPVHPI(SEQ ID NO.60);或
GLPSIPVHP{V或Nva)(SEQ ID NO.61);或
GLWSIPVHP{I或Nva}(SEQ ID NO.62);或
G{Nle}PSIPVHP{Nva}(SEQ ID NO.63);或
G{Nle或Nva}PSIPVHPV(SEQ ID NO.64);或
{A或Abu}LPSIPVHP{V或Nva}(SEQ ID NO.65);或
G{Nva}WPSIPVHP{I或V}(SEQ ID NO.66);或
A{Nva或Nle}WSIPVHPI(SEQ ID NO.67);或
A{V或Nva}PSIPVHPV(SEQ ID NO.68)。
特别地,所述分离肽可以包含或基本上由下述序列组成:
{Abu}LPSIPVHPI(SEQ ID NO.59);或
GLPSIPVHP{V或Nva}(SEQ ID NO.61);或
GLWSIPVHPI(SEQ ID NO.69);或
G{Nle}PSIPVHP{Nva}(SEQ ID NO.63)。
优选地,所述分离肽可以包含或基本上由下述序列组成:GLPSIPVHPV(SEQ ID NO.70)。
所述肽可以具有对于I类MHC肽结合裂口的亲和力,并且所述I类MHC可以例如是,HLA-A2。
其它实施方案涉及I类MHC/肽复合体,其中所述肽具有上文及本文其它地方所述的肽序列。I类MHC/肽复合体可以与识别I类MHC/PSMA288-297复合体的TCR交叉反应。所述I类MHC/肽复合体可以是HLA-A2/PSMA288-297复合体。
一些实施方案涉及包括如上文及本文其它地方所述的肽序列的多肽,所述肽序列包埋在释放序列内。
其它实施方案涉及包含上文及本文其它地方所述的肽的免疫原性组合物。
其它实施方案涉及编码或者用于表达如上文及本文其它地方所述的多肽的核酸或核酸工具(means),以及包括所述核酸或核酸工具的免疫原性组合物。
一些其它的实施方案涉及诱导、维持、或增强CTL应答的方法。所述方法可以包括结节内施用如上文及本文其它地方所述的组合物。
此外,一些方法涉及引发I类MHC-限制性T细胞应答的方法,所述方法可以包括结节内施用如上文及本文其它地方所述的组合物。所述方法还可以包括免疫强化剂的施用。
其它实施方案涉及包括在序列GLPSIPVHPI(SEQ ID NO.42)中有1-3个取代的分离肽,其具有对于I类MHC结合裂口的亲和力,所述亲和力相似于或大于GLPSIPVHPI(SEQ ID NO.42)对于所述I类MHC结合裂口的亲和力。半解离时间可以相似于或大于GLPSIPVHPI(SEQ ID NO.42)从所述I类MHC结合裂口半解离的时间。所述分离肽可以被具有针对肽GLPSIPVHPI(SEQ ID NO.42)的特异性的T细胞识别。
一些实施方案涉及包含这样的序列或基本上由其组成的分离肽,其中:
P0是X,XX,或XXX,其中X指定任何氨基酸或没有氨基酸;和
P1是S,K,F,Y,T,Orn,或Hse;和
P2是L,V,M,I,Nva,Nle,或Abu;和
P3是L,Nva,Nle或Abu;和
P4是Q;和
P5是H;和
P6是L,Nva,Nle,或Abu;和
P7是I;和
P8是G,A,S,或Sar;和
在P9的PΩ是L,V,I,A,Nle,Nva,Abu,或L-NH2;和
PΩ+1是X,XX,或XXX,其中X指定任何氨基酸或没有氨基酸;并且
其中所述序列不是SLLQHLIGL(SEQ ID NO.71)。
所述分离肽可以包含或基本上由下述序列组成:
{K,F,Y,T,Orn,或Hse}LLQHLIGL(SEQ ID NO.72);或
S{V,M,I,Nva,Nle,或Abu}LQHLIGL(SEQ ID NO.73);或
SL{Nva,Nle或Abu}QHLIGL(SEQ ID NO.74);或
SLLQH{Nva,Nle或Abu}IGL(SEQ ID NO.75);或
SLLQHLI{A,S,或Sar}L(SEQ ID NO.76);或
SLLQHLIG{V,I,A,Nle,Nva,Abu,或L-NH2}(SEQ ID NO.77);或
{F,Y,T,Orn,或Hse}{Nva,Nle,M,或I}LQHLIGL(SEQ ID NO.78);或
S{Nva,Nle,或M}LQHLIG{Nva,Nle,或V}(SEQ ID NO.79);或
{K,F,Y,T,Orn,或Hse}LLQHLIGV(SEQ ID NO.80);或
{F或T}LLQHLIG{Nle}(SEQ ID NO.81);或
{F或T){Nva或M}LQHLIG{Nle}(SEQ ID NO.82)。
此外,所述分离肽可以包含或基本上由下述序列组成:
{F,Y,T,Orn,或Hse)LLQHLIGL(SEQ ID NO.83);或
S{Nva,Nle,或M}LQHLIGL(SEQ ID NO.84);或
SLLQHLIG{Nle,Nva,或L-NH2}(SEQ ID NO.85);或
SLLQH{Nva或Abu}IGL(SEQ ID NO.86);或
S{Nva}LQHLIG{Nle}(SEQ ID NO.87);或
{F或T}{L或Nva}LQHLIG{Nle}(SEQ ID NO.88)。
此外,所述分离肽可以包含或基本上由下述序列组成:
S{L或Nva}LQHLIG{Nle}(SEQ ID NO.89);或
T{Nva}LQHLIG{Nle}(SEQ ID NO.90)。
所述分离肽可以包含或基本上由序列S{Nva}LQHLIG{Nle}(SEQ IDNO.87)组成。
所述分离肽可以具有对于I类MHC肽结合裂口的亲和力,并且例如,所述I类MHC可以是HLA-A2。
实施方案涉及I类MHC/肽复合体,其中所述肽可以具有上文及本文其它地方所公开的肽序列。I类MHC/肽复合体可以与识别I类MHC/PRAME425-433复合体的TCR交叉反应。所述I类MHC/肽复合体可以是HLA-A2/PRAME425-433复合体。
其它实施方案涉及包括如上文及本文其它地方所述的肽序列的多肽,所述肽序列与释放序列缔合。
其它实施方案涉及包含上文及本文其它地方所述的肽的免疫原性组合物。
一些实施方案涉及编码和用于表达如上文及本文其它地方所述的多肽的核酸和核酸工具,以及包括所述核酸及工具的免疫原性组合物。
一些其它的实施方案涉及诱导、维持、或增强CTL应答的方法,所述方法可以包括结节内施用如上文及本文其它地方所述的组合物。一些实施方案涉及引发I类MHC-限制性T细胞应答的方法,所述方法可以包括结节内施用如上文及本文其它地方所述的组合物。在一些实施方案中,所述方法还包括免疫强化剂的施用。
一些实施方案涉及包括在序列SLLQHLIGL(SEQ ID NO.71)中有1-3个取代的分离肽,其具有对于I类MHC结合裂口的亲和力,所述亲和力相似于或大于SLLQHLIGL(SEQ ID NO.71)对于所述I类MHC结合裂口的亲和力。半解离时间可以相似于或大于SLLQHLIGL(SEQ ID NO.71)从所述I类MHC结合裂口半解离的时间。所述分离肽可以被具有针对肽SLLQHLIGL(SEQ ID NO.71)的特异性的T细胞识别。
其它实施方案涉及产生并且获得包括(representing)免疫活性的并且在一个或多个MHC锚定残基携带非天然氨基酸的肽的组合物的方法。
本发明的另一个实施方案涉及pSEM质粒以及由这一质粒表达的与Melan-A26-35和/或酪氨酸酶369-377表位相对应的免疫原性肽。pSEM质粒以允许它们通过pAPCs表达并且呈递的方式而编码Melan-A和酪氨酸酶表位。pSEM质粒的详细信息在美国专利申请公布号20030228634中公开,所述专利申请通过引用完全结合于此。
在本发明的具体的实施方案中,提供由pSEM质粒表达的免疫原性肽的分离的肽类似物,其基本上由下述序列组成:E{A,L,Nva,或Nle}AGIGILT{V,Nva,或Nle}(SEQ ID NO.91);或Y{M,V,Nva,或Nle}DGTMSQ{V,Nva,或Nle}(SEQ ID NO.92);并且其中所述序列不是E{A或L}AGIGILTV(SEQ ID NO.93)或YMDGTMSQV(SEQ IDNO.94)。本发明的分离肽类似物可以选自由下列各项组成的组:ELAGIGILTNva(SEQ ID NO.95),ENvaAGIGILTV(SEQ ID NO.96),YVDGTMSQNva(SEQ ID NO.97),YVDGTMSQV(SEQ ID NO.98)和YMDGTMSQNva(SEQ ID NO.99)。
在其它实施方案中,所述分离肽类似物是基本上由氨基酸序列ENvaAGIGILTV(SEQ ID NO.96)组成的类似物。在其它实施方案中,所述分离肽类似物是基本上由氨基酸序列YMDGTMSQNva(SEQ ID NO.97)组成的类似物。在其它实施方案中,所述肽具有针对I类MHC肽结合裂口的亲和力。所述I类MHC是HLA-A2。
本发明的其它实施方案涉及包括在序列EAAGIGILTV(SEQ ID NO.100)中有1-3个取代的分离肽类似物,其具有对于I类MHC结合裂口的亲和力,所述亲和力相似于或大于EAAGIGILTV(SEQ ID NO.100)对于所述I类MHC结合裂口的亲和力。在其它实施方案中,半解离时间相似于或大于EAAGIGILTV(SEQ ID NO.100)从所述I类MHC结合裂口半解离的时间。在其它实施方案中,所述分离肽被具有针对肽EAAGIGILTV(SEQ IDNO.100)的特异性的T细胞识别。
在另一个实施方案中,本发明涉及包括在序列YMDGTMSQV(SEQID NO.94)中有1-3个取代的分离肽类似物,其具有对于I类MHC结合裂口的亲和力,所述亲和力相似于或大于YMDGTMSQV(SEQ ID NO.94)对于所述I类MHC结合裂口的亲和力。在其它实施方案中,半解离时间相似于或大于YMDGTMSQV(SEQ ID NO.94)从所述I类MHC结合裂口半解离的时间。在其它实施方案中,所述分离肽被具有针对肽YMDGTMSQV(SEQID NO.94)的特异性的T细胞识别。
本发明的实施方案还涉及I类MHC/肽复合体,其中所述肽具有下述肽序列:E{A,L,Nva,或Nle}AGIGILT{V,Nva,或Nle}(SEQ ID NO.91);或Y{M,V,Nva,或Nle}DGTMSQ{V,Nva,或Nle}(SEQ ID NO.92);并且其中所述序列不是E{A或L}AGIGILTV(SEQ ID NO.93)或YMDGTMSQV(SEQ ID NO.94)。在其它实施方案中,所述I类MHC/肽复合体与识别I类MHC/Melan-A26-35复合体的TCR交叉反应。所述I类MHC/肽复合体是HLA-A2/Melan-A26-35复合体。
在另一个实施方案中,所述I类MHC/肽复合体与识别I类MHC/酪氨酸酶369-377复合体的TCR交叉反应。所述I类MHC/肽复合体是HLA-A2/酪氨酸酶369-377复合体。
本发明的一些实施方案涉及包括包埋在释放序列内的下列肽序列的多肽:E{A,L,Nva,或Nle}AGIGILT{V,Nva,或Nle}(SEQ ID NO.91);或Y{M,V,Nva,或Nle}DGTMSQ{V,Nva,或Nle}(SEQ ID NO.92);其中所述序列不是E{A或L}AGIGILTV(SEQ ID NO.93)或YMDGTMSQV(SEQ ID NO.94)。在另一个实施方案中,本发明涉及包括下述的任何肽的免疫原性组合物:E{A,L,Nva,或Nle}AGIGILT{V,Nva,或Nle}(SEQ IDNO.91);或Y{M,V,Nva,或Nle}DGTMSQ{V,Nva,或Nle}(SEQ ID NO.92);并且其中所述序列不是E{A或L}AGIGILTV(SEQ ID NO.93)或YMDGTMSQV(SEQ ID NO.94)。本发明还涉及包括含有下述任何肽的多肽的免疫原性组合物:E{A,L,Nva,或Nle}AGIGILT{V,Nva,或Nle}(SEQ ID NO.91);或Y{M,V,Nva,或Nle}DGTMSQ{V,Nva,或Nle}(SEQ ID NO.92),并且涉及编码这样的多肽的核酸。本发明的实施方案还涉及包括所述核酸的免疫原性组合物。
本发明的免疫原性组合物可以作为针对癌症诸如成胶质细胞瘤(glioblastoma)和黑素瘤的免疫策略的引发部分而施用,但是并不限于此。另外,与Melan-A26-35和酪氨酸酶369-377表位及表位类似物相对应的肽可以作为同一免疫策略的增强部分而施用。在优选的实施方案中,所述肽类似物E{A,L,Nva,或Nle}AGIGILT{V,Nva,或Nle}(SEQ ID NO.91);或Y{M,V,Nva,或Nle}DGTMSQ{V,Nva,或Nle}(SEQ ID NO.92)可以用于增强步骤。本发明所用的引发-和-增强流程如在美国专利公布号20050079152和美国临时专利申请号60/640,402中更详细地公开,二者的题目皆为METHODS TO ELICIT,ENHANCE AND SUSTAIN IMMUNERESPONSES AGAINST MHC CLASS I-RESTRICTED EPITOPES,FORPROPHYLACTIC OR THERAPEUTIC PURPOSES(用于预防或治疗目的,激发、增强并且维持针对I类MHC-限制性表位的免疫应答的方法),其每一个都通过引用完全结合于此。
因此,在一个实施方案中,提供诱导、维持或增强CTL应答的方法。所述方法可以包括结节内施用包括编码某种多肽的核酸的免疫原性组合物,所述多肽包括由pSEM质粒表达的免疫原性肽的肽序列,所述肽序列基本上由下述序列组成:E{A,L,Nva,或Nle}AGIGILT{V,Nva,或Nle}(SEQ ID NO.91);或Y{M,V,Nva,或Nle}DGTMSQ{V,Nva,或Nle}(SEQ ID NO.92)。在其它实施方案中,提供一种引发I类MHC-限制性T细胞应答的方法,所述方法包括结节内施用免疫原性组合物和免疫强化剂。在其它实施方案中,提供诱导、维持或引发CTL应答的方法,所述方法包括结节内施用本文公开的任何免疫原性组合物。
附图简述
图1A和B总结对于SSX-241-49类似物分别在九聚体(nonamer)和十聚体的每个单独的氨基酸位置的取代。
图2是鉴定类似物的优选实施方案方法的示意图。
图3是显示在单一位置取代的SSX-241-49类似物的交叉反应性和功能亲和力的表格。
图4是显示在两个位置取代的SSX-241-49类似物的交叉反应性和功能亲和力的表格。
图5是显示在多于两个位置取代的SSX-241-49类似物的交叉反应性和功能亲和力的表格。
图6是显示包括指定(nominal)的41-49肽的SSX-241-49十聚体类似物的交叉反应性和功能亲和力的表格。
图7是显示SSX-241-49类似物注射时间表的图表。
图8是显示SSX-241-49A42V、A42L类似物和野生型在肿瘤细胞裂解物中的活性的柱状图。
图9是显示对于体内细胞毒性研究和离体(ex vivo)细胞毒性研究的注射时间表以及用于加强的SSX-241-49类似物肽的时间表。
图10是显示与对照(野生型肽)和EAA(Melan-A 26-35)相比,许多类似物的体内特异性裂解结果的表格。
图11是显示与对照(野生型肽)和EAA相比,许多SSX-241-49类似物的体内特异性裂解结果,以及MHC结合和MHC稳定性的表格。
图12是显示与野生型对照相比,用许多类似物免疫后所获得的肿瘤细胞(624.38人肿瘤细胞)的特异性裂解百分数的柱状图。
图13A-C是总结分别在九聚体和十聚体的每个单独的氨基酸位置的取代,以及对于每个所获得的结果的表格。
图14是显示对于分析和检测NY-ESO-1类似物所用的注射时间表的时间表。
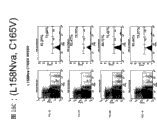
图15A-C显示当通过从受激发的动物移除脾和PBMC并且通过流式细胞术测量CFSE荧光所测量的靶细胞的特异性消除。
图16A和B是显示在用NY-ESO-1类似物加强后,针对用野生型肽包被的靶细胞的体内细胞毒性的柱状图。
图17A和B是显示当通过细胞因子的产生进行评估时,对所述类似物引发针对所述野生型表位的增强的免疫性的能力的离体分析的柱状图。
图18图示用于确认PSMA288-297表位的抗原性的流程,以及所述检测的结果。
图19是显示在单一位置取代的PSMA288-297类似物的交叉反应性和功能亲和力的表格。
图20是显示在两个位置取代的PSMA288-297类似物的交叉反应性和功能亲和力的表格。
图21是显示在多于两个位置取代的PSMA288-297类似物的交叉反应性和功能亲和力的表格。
图22是显示通过Elispot测定的各种PSMA288-297类似物的免疫原性的柱状图。
图23是显示通过Elispot测定的I297V类似物抗-PSMA288-297应答的增强的线状图。
图24是显示用I297V类似物加强的结果的柱状图。所述检测显示所述加强导致针对PSMA+人肿瘤系的细胞毒性免疫性。
图25图示确认PRAME425-433表位抗原性的流程,以及所述检测的结果。
图26是显示在单一位置取代的PRAME425-433类似物的交叉反应性和功能亲和力的表格。
图27A和B是显示在两个位置取代的PRAME425-433类似物的交叉反应性和功能亲和力的表格。
图28是显示在多于两个位置取代的PRAME425-433类似物的交叉反应性和功能亲和力的表格。
图29是显示通过Elispot测定的PRAME425-433类似物的免疫原性的柱状图。
图30显示使用L426Nva L433Nle类似物进行加强的结果。所述检测表明所述加强导致针对天然表位包被的细胞的细胞毒性免疫性。
图31显示用于PRAME类似物的体内评估的流程,以及显示所述评估的结果的柱状图。
图32显示在类似物诱导的、天然表位重新刺激的T细胞内产生细胞因子的离体刺激的流程,及显示所述评估的结果的柱状图。
图33是显示用L426Nva L433Nle类似物进行加强的结果的柱状图。所述检测表明所述加强导致针对人肿瘤细胞系的细胞毒性免疫性。
图34描述针对PRAME425-433体外免疫的流程。
图35显示在用PRAME425-433类似物体外免疫后四聚体分析的结果。
图36描述质粒pCTLR2的结构,其为表达PRAME425-433表位的质粒,。
图37是显示其中人肿瘤细胞(624.38)被T细胞裂解的实验的检测结果的柱状图,其中所述T细胞用质粒DNA激活并且用肽加强。
图38是显示在用Tyr369-377质粒激活和用V377Nva类似物肽加强后的四聚体分析的结果的柱状图。
图39是显示针对类似的酪氨酸酶和Melan A表位的体内应答的柱状图。
图40是显示酪氨酸酶类似物免疫原性评估流程的时间表。
图41是显示针对与来自HHD的效应细胞接触的624.38细胞的免疫应答结果的柱状图,所述HHD用质粒激活并且用Tyr369-377类似物加强。
优选实施方案详述
包含T细胞表位的肽通常是弱免疫原或免疫调节剂,原因在于下列多种因素的一种:亚最佳的药物代谢动力学模式,与MHC分子的有限结合(减小的Kon和增加的Koff),或在正常免疫所有组成成分中存在的T细胞的减少的内在识别(例如,通过各种形式的耐受性)。已经寻找了许多方法来提高肽的免疫特性,特别是其序列不同于天然表位的肽的筛选和应用。在本领域内,这样的类似物通过各种命名而已知,诸如杂环(heteroclytic)肽和改变的肽配体(APL)。这样的类似物的产生最经常地应用来自于遗传编码的残基的标准形式的氨基酸(参见,例如,Valmori,D.等.,J.Immunol.(免疫学杂志)160:1750-1758,1998)。典型地,非标准氨基酸的应用与提高所述肽的生化稳定性的努力相关(参见,例如,Blanchet,J.-S.等.,J.Immunol.(免疫学杂志)167:5852-5861,2001)。
一般地,可以将类似物分类成下述两种主要类别:(1)修饰肽锚定残基,以获得更好的HLA结合模式和更高的免疫应答,和(2)修饰肽锚定残基和TCR接触残基,以避免T细胞对自身抗原的耐受性。
本文所述发明的一些实施方案涉及具有至少一种下述保留的或提高的特性的类似物,其包括但不限于:
1.与TCR的交叉反应性和功能亲和力;
2.与I类MHC结合的亲和力和稳定性;
3.对免疫性的体内作用,通过细胞毒性进行评估;
4.对免疫性的体内作用,通过IFN-γ的离体产生进行评估;和/或
5.对蛋白质水解的增加的抗性。
一些实施方案涉及肽序列,其包括类似物,其中所述序列的氨基酸用位置指示显示,例如,P1,P2,P3,PΩ等。另外,所述肽序列可以显示为包括P0和/或PΩ+1指示。在一些方面中,P0可以是X,XX,或XXX,其中X是任何氨基酸或没有氨基酸。类似地,在一些方面中,PΩ+1可以是X,XX,或XXX,其中X是任何氨基酸或没有氨基酸。因此,例如,XXX可以意指任何氨基酸残基的任何组合或没有氨基酸残基。因此,这些实施方案可以包括在特定序列的N端或C端具有多达3个添加的氨基酸(具有氨基酸残基的任何组合)的多肽。并且,在一些方面中,所述实施方案可以在N端或C端不包括另外的氨基酸残基。
在本领域内很好理解负责形成结合口袋的MHC残基,哪个结合口袋容纳表位锚定残基,并且因此定义MHC分子的结合特异性。这样的信息的一种汇编可以在FIMM(功能免疫学)网址以超文本转移链接(http://)″sdmc.lit.org.sg:8080/fimm/.″找到,将其全部内容并入本文作为参考。(还可以参见C.,Koh J.L.Y.,Sheng X.,Wong L.,和V.Brusic.FIMM,a database of functional molecular immunology(功能分子免疫学数据库).Nucleic Acids Research(核酸研究),2000.卷28.No.1222-224;和C.,Koh JL,Flower DR,Wong L.,和Brusic V.FIMM,功能分子免疫学数据库;2002更新。Nucleic Acids Research(核酸研究),2002.卷30.No.1226-229;它们中的每一个通过参考完全并入本申请中)。
当用于本文时,短语“释放序列”是指包括或编码表位或类似物的肽,其被包埋在更大的序列中,所述更大的序列提供容许所述表位或类似物通过免疫蛋白酶的加工,直接地或者与N端修剪或其它生理性过程组合,而被释放出来的背景环境(context)。在一些方面中,所述类似物或表位可以是设计的或被改造的。
其它实施方案涉及表位阵列和其它多肽,其包括可以被处理而释放所述类似物的表位类似物序列。其它实施方案涉及核酸,特别是DNA质粒,其编码所述多肽,或只是编码类似物,以及它们从所述核酸的表达。所述类似物、包含它们的多肽、和编码核酸可以全部都是免疫原性组合物的成分,特别是适于淋巴内递送的组合物,所有这些组合物涉及其它实施方案。
具有提高的免疫特性的肽类似物可以通过修饰参与同MHC分子相互作用的锚定残基而设计,以增加结合并且稳定MHC-肽复合体的形成。这样的修饰可以由限制性MHC分子的结合基序或优选锚定残基的知识而指导。还存在可以用来预测携带各种取代的类似物的特性的各种规则、指标和运算法则,限制条件是,所述取代选自遗传可编码的氨基酸的标准系列。
然而,没有预测用非标准氨基酸置换锚定残基的结果的数据库或运算法则,并且先前没有充分研究它们的有效性。本文公开了非标准氨基酸正亮氨酸(Nle)和正缬氨酸(Nva)可以有利地取代MHC-结合肽的锚定残基位置。优选地,它们应该被置于由疏水性或大的氨基酸,特别是I、L、或V有利占据的位置。
MHC-结合基序通常依据在8-10个氨基酸跨度内指定位置的优选残基侧链而定义(参见,例如,Rammensee等.,″MHC Ligands and PeptideMotifs,(MHC配体和肽基序)″(Molecular Biology Intelligence Unit(分子生物学信息所)),Springer-Verlag,德国,1997兰迪斯生物科学(LandesBioscience),奥斯汀,德克萨斯州;和Parker,等.,″Scheme for rankingpotential HLA-A2 binding peptides based on independent binding ofindividual peptide side-chains,(基于单个肽侧链的独立结合排列潜在的HLA-A2结合肽的方案)″J.Immunol.(免疫学杂志)152:163-175)。网上运算法则也是可用的,其可以用来预测MHC结合。参见,例如,Hans-GeorgRammensee,Jutta Bachmann,Niels Emmerich,Stefan Stevanovic的全球网页:SYFPEITHI:关于MHC配体和肽基序的国际互联网数据库(AnInternet Database for MHC Ligands and Peptide Motifs)(超文本转移链接访问通过:syfpeithi.bmi-heidelberg.com/scripts/MHCServer.dll/home.htm),和″bimas.dcrt.nih.gov/molbio/hla_bind″。对于I类-限制性表位,C端位置,PΩ,典型地是初级锚定基。第二个位置,P2,也通常是初级锚定基,或者,备选地,P3和/或P5可以起到这种作用。位置P2到P7都被认为是用于一种或另一种MHC的次级或辅助性锚定位置(参见Rammensee等.,和参见美国专利申请公布号20030215425的表6(美国专利申请号10/026,066,于2001年12月7日递交,题目为EPITOPE SYNCHRONIZATION INANTIGEN PRESENTING CELLS(抗原呈递细胞中的表位同步性);其通过参考将其全部公开内容完全并入本申请中)。对于II类-限制性表位,P1,P4,P6,P7和P9已被认为是锚定位置。前述内容意欲作为一般指导,并且应该被视为是示例性的而不是详尽的或限制性的。结合基序、锚定残基等的许多分析和汇编可以在科学和专利文献中以及在国际互联网上找到。当与本文的教导相结合时,它们的惯例和结果进一步为本领域的技术人员提供关于设计表位类似物的有用的指导。
实际上结合到呈递MHC分子上的肽的长度可以比指定的基序序列更长。II类MHC分子的结合裂口末端是开放的,以便所结合的肽可以在核心基序的任一端延伸。相反,在I类MHC分子中所述结合裂口在两端是闭合的,以致所结合的肽的末端通常必须与所述基序相对应,然而,长度上的显著变化可以通过将所结合的肽的中心区域凸起和折叠而进行调整,以致长度上多达至少大约14个氨基酸的肽可被呈递(参见,例如,Probst-Kepper,M.等.,J.Immunol.(免疫学杂志)173:5610-5616,2004)。
表位类似物可以具有关于与I类MHC分子相互作用的提高的Kon和Koff,以及保留的或增加的与识别初始表位的T细胞受体的相互作用,在特异性T细胞群体增加的扩展中所反映出来的改进的或提高的体内或离体活性,通过特异性T细胞的提高的细胞因子生产,或针对携带天然表位的靶点的体内或体外细胞毒性,所述细胞毒性由与所述肽反应的T细胞介导。另外,这样的类似物可以以更理想的方式与多种不同的I类MHC分子相互作用。
这样具有提高的免疫特性的肽类似物可以包括一种或多种取代,其包括一种或多种非标准氨基酸取代。在非标准氨基酸取代中,由于,如下文示例,它们不但可以提高与I类MHC的相互作用,而且可以保持与对天然表位特异性的TCR的交叉反应性,并且表现出提高的体内免疫模式,所以由正缬氨酸或正亮氨酸组成的对初级锚定残基的取代是优选的。例如,将P2氨基酸残基从A、L或V突变成正缬氨酸或正亮氨酸,改善了免疫特性,并且因此是优选的。另外,将C端残基修饰成正缬氨酸或优选地正亮氨酸,改善了所述类似物的免疫特征。另外,包括在初级和/或次级锚定残基的多种取代的类似物可以与改善的免疫特性相关,所述类似物包括在P2或PΩ的正缬氨酸和/或正亮氨酸。
正缬氨酸(Nva)和正亮氨酸(Nle)的某些应用在美国专利号6,685,947、PCT公布号WO 03/076585 A2和WO 01/62776 A1以及美国专利公布号20040253218A1中提及。这些参考文献没有教导在MHC结合肽的锚定位置取代的Nva或Nle提高免疫特性的一般用途。所述‘218公布教导所取代的残基应该结合在TCR-相互反应位置,而不是MHC-相互反应位置。
在本发明的另一个实施方案中,所述肽是衍生于NS-特异性抗原的肽的类似物,所述NS-特异性抗原是免疫原性的但不是致脑炎性的。用于这一目的最适宜的肽是那些其中致脑炎性自身肽在T细胞受体(TCR)结合位点而不是在MHC结合位点被修饰的肽,以致免疫应答被激活而不是使之无反应性(Karin等,1998;Vergelli等,1996)。
其他人还提议各种非标准氨基酸可以被取代而并不破坏肽的用途(参见,例如WO 02/102299A)。非标准氨基酸还可以用来研究TCR和MHC-肽复合体之间的相互作用(参见,例如WO 03/076585A和Sasada,T.等.Eur.J.Immunol.(欧洲免疫学杂志)30:1281-1289,2000)。Baratin显示了在由鼠MHC分子H2-Db呈递的p53肽中Nle和Abu在非锚定位置和Nle在锚定位置的一些应用(J.Peptide Sci.(肽科学杂志)8:327-334,2002)。上述文件的每一个都通过引用完全结合于此。
WO 01/62776中所公开的结合Nle的HLA-A2.1-限制性肽衍生于CEA、p53、和MAGE-3。在CEA肽I(Nle)GVLVGV和p53肽S(Nle)PPPGTRV(SEQ ID NO.101)中,Nle存在于P2位置。没有提供关于正亮氨酸的一般用途的教导,并且没有提供当与天然序列比较时,表明这些取代怎样或者是否改变所述类似物的特性的公开内容。
本发明实施方案的一些涉及在促进与MHC结合的位置结合Nva和/或Nle的表位类似物。一些实施方案特异地排斥在HLA-A2.1-限制性表位,来自CEA、p53、和/或MAGE-3的HLA-A2.1表位,或衍生于MAGE-3、CEA、和/或p53的其它肽中应用Nle和/或Nva。在一些实施方案中,特异性排除了在上述引用的专利参考文献中公开的一种或多种具体序列。在其它实施方案中,排除鼠或其它非人MHC-限制性表位的类似物。其它示例性实施方案包括Nle和/或Nva在P3、P5、和/或PΩ锚定位置、在辅助性锚定位置的应用,以在不是衍生于癌基因或胎性癌蛋白的肽的锚定位置,和在衍生于CT抗原的肽的锚定位置制备非-A2-或非-A2.1-HLA限制性表位的类似物。
一般地,这样的类似物可以有效用于各种疾病,诸如感染、癌症或炎症疾病的免疫治疗和/或预防,其作为单一药剂或在组合治疗中而应用。这是由于它们与MHC分子和T细胞受体的最优化相互作用,其是免疫应答发生和调控的关键。
类似物制备
所述类似物可以应用本领域的技术人员已知的任何方法而制备,包括应用肽合成方法,或表达编码需要的肽类似物的核酸而制备所述肽。因此,当所述类似物包括一种或多种非标准氨基酸时,更可能地,它们通过肽制备方法而产生。当所述类似物仅包括一种或多种标准氨基酸的取代时,它们可以应用本领域的技术人员已知的任何方法从表达载体表达出来。备选地,所述肽可以应用基因治疗方法而表达。
类似物检测
为了评估类似物的有效性和/或活性、和/或改善的特性并且以任何方式将所述类似物与野生型相比较,进行一种或多种下述检测:对于HLA-A*0201的肽结合亲和力;肽-HLA-A*0201复合体稳定性检测;交叉反应性检测(通过野生型肽-特异性的CTL识别肽类似物,或通过应用肽类似物所产生的CTL来识别野生型肽);免疫原性检测,诸如IFN-γ分泌检测,细胞毒性检测,和/或Elispot检测;抗原性检测,诸如体外肿瘤细胞裂解检测,离体肿瘤细胞裂解,和体内肿瘤细胞裂解;以及蛋白质水解检测,以鉴定对蛋白质水解的增加的抗性。示例性检测的详细内容在下述实施例中陈述。
应用上述方法,鉴定有用的和/或改善的类似物。对于有用,类似物可以不必在所述被鉴定的检测中被发现是改善的。例如,有用的肽可以含有其它特性,诸如在耐受性患者中有用或抗蛋白质水解。对于改善,可以发现肽在与TCR结合、与MHC分子结合中具有明显的提高,并且有提高的免疫应答或任何其它生物活性。在一些实例中,当应用鼠检测系统时,有用的肽似乎不是改善的,但是由于在人免疫系统中的差异,当在人中检测时确定是改善的。在一些情形中,所述的有用性可以源于在耐受性患者中破坏耐受的能力。在一些实例中,所述有用性可以源于这样的能力,即,应用所述肽作为基础用于进一步的取代以鉴定改善的类似物。
类似物的应用
应用所公开的类似物诱导、引发(entraining)、维持、调控并且增强I类MHC-限制性T细胞应答、和特别是针对抗原的效应和记忆CTL应答的有效方法在下列各项中描述:美国专利号6,994,851(2/7/06)和6,977,074(12/20/2005),二者题目皆为“A Method of Inducing a CTL Response”(“诱导CTL应答的方法”);美国临时申请号60/479,393,于2003年6月17日提交,题目为“METHODS TO CONTROL MHC CLASS I-RESTRICTEDIMMUNE RESPONSE”(“控制I类MHC-限制性免疫应答的方法”);和于2004年12月29日提交的美国专利申请号10/871,707(公布号20050079152)和临时美国专利申请号60/640,402,二者题目皆为“METHODSTO ELICIT,ENHANCE AND SUSTAIN IMMUNE RESPONSESAGAINST MHC CLASS I-RESTRICTED EPITOPES,FORPROPHYLACTIC OR THERAPEUTIC PURPOSE”(“用于预防或治疗目的,激发、增强并且维持针对I类MHC-限制性表位的免疫应答的方法”)。所述类似物还可以用于研究中,以获得进一步优化的类似物。许多管家表位在下列各项中提供:美国申请号10/117,937,于2002年4月4日提交(公布号20030220239 A1),和10/657,022(20040180354),和PCT申请号PCT/US2003/027706(公布号WO04022709A2),于2003年9月5号提交;和美国临时申请号60/282,211,其于2001年4月6日提交;60/337,017,其于2001年11月7日提交;60/363,210,于2002年3月7日提交;和60/409,123,其于2002年9月5日提交;这些申请的每一个题目都是“EPITOPE SEQUENCES”(“表位序列”)。所述类似物还可以用于这些申请中所描述的各种模式中的任一种。表位簇,其可以包括或含有本发明类似物,在美国专利申请号09/561,571中公开并且更加充分地定义,所述美国专利申请号09/561,571于2000年4月28日提交,题目为“EPITOPE CLUSTERS”(“表位簇”)。应用和递送本发明类似物的方法学在美国专利申请09/380,534和6977074(2005年12月20日授权),和在PCT申请号PCTUS98/14289(公布号WO9902183A2)中描述,上述每一申请题目为“A METHOD OFINDUCING A CTL RESPONSE”(“诱导CTL应答的方法”)。对于这样的免疫治疗的有益表位选择原则在下列各项中公开:于2000年4月28日提交的美国专利申请号09/560,465,于2001年12月7日提交的10/026,066(公布号20030215425 A1),和于2001年11月7日提交的10/005,905,上述所有专利申请题目皆为“EPITOPE SYNCHRONIZATION IN ANTIGENPRESENTING CELLS”(“抗原呈递细胞中的表位同步性”);6,861,234(2005年3月1日授权;申请号09/561,074),题目为“METHOD OF EPITOPEDISCOVERY(“表位发现的方法”)”;09/561,571,于2000年4月28日提交,题目为“EPITOPE CLUSTERS”(“表位簇”);10/094,699(公布号20030046714 A1),于2002年3月7日提交,题目为“ANTI-NEOVASCULATURE PREPARATIONS FOR CANCER”(“用于癌症的抗-新生脉管系统制剂”);申请号10/117,937(公布号20030220239A1)和PCTUS02/11101(公布号WO02081646A2),二者皆于2002年4月4日提交,并且题目皆为“EPITOPE SEQUENCES”(“表位序列”);和申请号10/657,022和PCT申请号PCT/US2003/027706(公布号WO04022709A2),二者皆于2003年9月5日提交,并且题目皆为“EPITOPESEQUENCES”(“表位序列”)。疫苗质粒的综合设计方面在下列各项中公开:美国专利申请号09/561,572,于2000年4月28日提交,题目为“EXPRESSION VECTORS ENCODING EPITOPES OFTARGET-ASSOCIATED ANTIGENS”(“编码靶点-相关抗原的表位的表达载体”),和10/292,413(公布号20030228634 A1),于2002年11月7日提交,题目为“EXPRESSION VECTORS ENCODING EPITOPES OFTARGET-ASSOCIATED ANTIGENS AND METHODS FOR THEIRDESIGN”(“编码靶点-相关抗原的表位的表达载体及它们的设计方法”);于2002年8月20日提交的10/225,568(公布号2003-0138808),于2003年8月19日提交的PCT申请号PCT/US2003/026231(公布号W02004/018666),二者题目皆为“EXPRESSION VECTORS ENCODING EPITOPES OFTARGET-ASSOCIATED ANTIGENS”(“编码靶点-相关抗原的表位的表达载体”);和美国专利号6,709,844,题目为“AVOIDANCE OFUNDESIRABLE REPLICATION INTERMEDIATES IN PLASMIDPROPAGATION”(“在质粒增殖中避免不需要的复制中间体”)。在引导针对具体癌症的免疫应答中特别有益的特异性抗原组合在下列各项中公开:于2003年6月17日提交的临时美国专利申请号60/479,554,和于2004年6月17日提交的美国专利申请号10/871,708,和PCT专利申请号PCT/US2004/019571(公布号WO 2004/112825),所有这些题目皆为“COMBINATIONS OF TUMOR-ASSOCIATED ANTIGENS INVACCINES FOR VARIOUS TYPES OF CANCERS”(“肿瘤-相关抗原在用于各种类型的癌症的疫苗中的组合”)。与肿瘤新生脉管系统相关的抗原(例如,PSMA,VEGFR2,Tie-2)还与癌症疾病相关应用,如在美国专利申请号10/094,699(公布号20030046714 A1)中所公开的那样,其于2002年3月7日提交,题目为“ANTI-NEOVASCULATURE PREPARATIONS FORCANCER”(“用于癌症的抗-新生脉管系统制剂”)。通过生物应答调节物的靶点施用而引发、维持和调控免疫应答的方法在于2004年12月29日提交的美国临时申请号60/640,727中公开。在免疫应答诱导中绕过CD4+细胞的方法在于2004年12月29号提交的美国临时申请号60/640,821中公开。示例性的疾病,生物体,以及与目标生物体、细胞和疾病相关的抗原和表位在美国申请号6977074(于2005年12月20日授权)中描述,所述申请于2001年2月2日提交,题目为“METHOD OF INDUCING A CTLRESPONSE”(“诱导CTL应答的方法”)。示例性的方法学在2004年6月17日提交的美国临时申请号60/580,969和2006年1月12日公布的美国专利申请号2006-0008468-A1中找到,所述申请的题目皆为“COMBINATIONS OF TUMOR-ASSOCIATED ANTIGENS INDIAGNOTISTICS FOR VARIOUS TYPES OF CANCERS”(“肿瘤-相关抗原在各种类型的癌症的诊断中的组合”)。方法学和组合物还在美国临时申请号60/640,598中公开,其于2004年12月29日提交,题目为“COMBINATIONS OF TUMOR-ASSOCIATED ANTIGENS INCOMPOSITIONS FOR VARIOUS TYPES OF CANCER”(“肿瘤-相关抗原在用于各种类型的癌症的组合物中的组合”)。评估并且监测用包括应用本发明类似物的免疫方法的免疫应答性的诊断技术的综合在于2004年6月17日提交的临时美国专利申请号60/580,964和于2005年12月29日公布的美国专利申请号US-2005-0287068-A1中更加充分地讨论,所述两个申请的题目皆为“IMPROVED EFFICACY OF ACTIVE IMMUNOTHERAPY BYINTEGRATING DIAGNOSTIC WITH THERAPEUTIC METHODS”(“通过结合诊断和治疗方法提高主动免疫治疗的功效”)。免疫原性多肽编码载体在下列各项中公开:美国专利申请号10/292,413(公布号20030228634A1),于2002年11月7日提交,题目为EXPRESSION VECTORS ENCODINGEPITOPES OF TARGET-ASSOCIATED ANTIGENS AND METHODSFOR THEIR DESIGN(编码靶点-相关抗原的表位的表达载体及它们的设计方法),和美国临时申请号60/691,579,于2005年6月17日提交和相应的美国专利申请序列号______(代理卷号:MANNK.053A,与本申请在同一日提交),题目皆为“METHODS AND COMPOSITIONS TO ELICITMULTIVALENT IMMUNE RESPONSES AGAINST DOMINANT ANDSUBDOMINANT EPITOPES EXPRES SED ON CANCER CELLS ANDTUMOR STROMA”(“激发针对在癌细胞和肿瘤基质上表达的优势和次优势表位的多价免疫应答的方法和组合物”)。包括实质方法和组合物的其它有用的公开内容在美国临时申请号60/691,581中找到,其于2005年6月17日提交,题目为“MULTIVALENT ENTRAIN-AND-AMPLIFYIMMUNOTHERAPEUTICS FOR CARCINOMA”(“用于癌症的多价引发-和-增强免疫治疗剂”)。其它方法学、组合物、肽和肽类似物在美国临时申请号60/581,001和60/580,962中公开,上述申请皆于2004年6月17日提交,并且题目分别为“SSX-2 PEPTIDE ANALOGS”(“SSX-2肽类似物”)和“NY-ESO PEPTIDE ANALOGS”(“NY-ESO肽类似物”)。在上段中提及的每一申请和专利全部通过参考将它们所教导的全部内容结合于本申请中。其它类似物、肽和方法在下列各项中公开:美国专利申请公布号20060063913,题目为“SSX-2PEPTIDE ANALOGS”(“SSX-2肽类似物”);和于2006年3月16日公布的美国专利公布号2006-0057673A1,题目为“EPITOPE ANALOGS”(“表位类似物”);和PCT申请公布号WO/2006/009920,题目为“EPITOPE ANALOGS”(“表位类似物”);所有申请于2005年6月17日提交,以及美国临时专利申请号60/691,889,其于2005年6月17日提交,题目为EPITOPE ANALOGS(表位类似物);和美国专利申请号__/______,题目为PRAME PEPTIDE ANALOGUES(PRAME肽类似物)(代理卷号:MANNK.052A),美国专利申请号__/______,题目为PSMA PEPTIDE ANALOGUES(PSMA肽类似物)(代理人卷号:MANNK.052A2),和美国专利申请号__/______,题目为MELANOMA ANTIGEN PEPTIDE ANALOGUES(黑素瘤抗原肽类似物)(代理人卷号:MANNK.052A3),其中每一个通过引用完全结合于此。示例性的免疫原性产品在下述中公开:于2005年6月17日提交的美国临时专利申请号60/691,581,和正好在本申请日期提交的美国专利申请号__/______
(代理人卷号:MANNK.054A),每一申请题目为MULTIVALENTENTRAIN-AND-AMPLIFY IMMUNOTHERAPEUTICS FORCARCINOMA(用于癌症的多价引发-和-增强免疫治疗剂),并且每一申请通过引用完全结合于此。其它方法和组合物在下述中公开:美国临时申请号60/581,001,于2004年6月17日提交,题目为“SSX-2 PEPTIDEANALOGS”(“SSX-2肽类似物”),和美国临时申请号60/580,962,于2004年6月17日提交,题目为“NY-ESO PEPTIDE ANALOGS”(“NY-ESO肽类似物”);每一申请通过引用完全结合于此。通过引用明确结合于本文中的其它申请为:美国专利申请系列号11/156,253(公布号:),于2005年6月17日提交,题目为“SSX-2 PEPTIDE ANALOGS”(“SSX-2肽类似物”);美国专利申请系列号11/155,929,于2005年6月17日提交,题目为“NY-ESO-1 PEPTIDE ANALOGS”(“NY-ESO-1肽类似物”)(公布号);美国专利申请系列号11/321,967,于2005年12月29日提交,题目为“METHODS TO TRIGGER,MAINTAIN AND MANIPULATE IMMUNERESPONSES BY TARGETED ADMINISTRATION OF BIOLOGICALRESPONSE MODIFIERS INTO LYMPHOID ORGANS”(“通过向淋巴器官中靶点施用生物应答调节剂而引发、维持并且处理免疫应答的方法”);美国专利申请系列号11/323,572,于2005年12月29日提交,题目为“METHODS TO ELICIT ENHANCE AND SUSTAIN IMMUNEREPONSES AGAINST MCH CLASS I RESTRICTED EPITOPES,FORPROPHYLACTIC OR THERAPEUTIC PURPOSES”(“为了预防或治疗目的,激发、增强并且维持针对I类MHC限制性表位的免疫应答的方法”);美国专利申请系列号11/323,520,于2005年12月29日提交,题目为“METHODS TO BYPASS CD4+CELLS IN THE INDUCTION OF ANIMMUNE RESPONSE”(“在诱导免疫应答时绕过CD4+细胞的方法”);美国专利申请系列号11/323,049,于2005年12月29日提交,题目为“COMBINATION OF TUMOR-ASSOCIATED ANTIGENS INCOMPOSITIONS FOR VARIOUS TYPES OF CANCERS”(“肿瘤-相关抗原在用于各种类型的癌症的组合物中的组合”);美国专利申请系列号11,323,964,于2005年12月29日提交,题目为“COMBINATIONS OFTUMOR-ASSOCIATED ANTIGENS IN DIAGNOSTICS FOR VARIOUSTYPES OF CANCERS.”(肿瘤-相关抗原在用于各种类型的癌症的诊断剂中的组合)。作为实例,而不是局限于其,每一参考文献通过引用将它们所教导的关于I类MHC-限制性表位、类似物、类似物的设计、表位和类似物的应用、应用和制备表位的方法、和用于它们的表达的核酸载体的设计与应用、以及制剂的内容结合到本申请中。
抗原
存在许多抗原,其表位可以被T细胞以MHC-限制性方式识别,因此,针对它们的免疫应答的操作具有治疗或预防潜力。本文所描述的用于制备MHC-结合肽的类似物的原理通常适用于这些抗原及其表位的任一种。本公开内容特别关注的是来源于肿瘤相关抗原(TuAA)SSX-2、NY-ESO-1、PRAME、PSMA、酪氨酸酶、和Melan-A的表位。
SSX-2,也叫作Hom-Mel-40,是高度保守的睾丸癌抗原家族的一员(Gure,A.O.等.Int.J.Cancer(国际癌症杂志)72:965-971,1997,其通过参考全部并入本申请)。其作为TuAA抗原的鉴定在题目为“ISOLATEDNUCLEIC ACID MOLECULES THAT ENCODE A MELANOMASPECIFIC ANTIGEN AND USES THEREOF”(“编码黑素瘤特异性抗原的分离的核酸分子及其应用”)的美国专利6,025,191中教导,其通过参考全部并入本申请中。睾丸癌抗原在许多肿瘤中发现,但是在除了睾丸外的正常成人组织中一般不存在。SSX-2表达在许多不同类型的肿瘤中,包括滑膜肉瘤、黑素瘤、头颈癌、乳腺癌、结肠和卵巢癌。除了其在各种癌症中的广泛表达,它在患有晚期疾病的患者中也是免疫原性的。并且,存在这样的证据,即,在转移肿瘤患者中有针对这种抗原的自发的体液和细胞免疫应答(Ayyoub M,等.,Cancer Res.(癌症研究)63(17):5601-6,2003;Ayyoub M,等.J Immunol.(免疫学杂志)168(4):1717-22,2002),其通过参考完全并入本申请中。最近应用反式T细胞免疫学,已经鉴定了两种HLA-A2限制性T细胞表位,即SSX-241-49(Ayyoub M,等.J Immunol.(免疫学杂志)168(4):1717-22,2002;美国专利号6,548,064,题目为“ISOLATEDPEPTIDES CONSISTING OF AMINO ACID SEQUENCES FOUND INSSX OR NY-ESO-1 MOLECULES,THAT BIND TO HLA MOLECULE”(“与HLA分子结合的由在SSX或NY-ESO-1分子中发现的氨基酸序列组成的分离的肽”);美国专利申请号10/117,937(公布号US 2003-0220239A1),题目为“EPITOPE SEQUENCES”(“表位序列”))和SSX-2103-111(Wagner C,等.Cancer Immunity(癌症免疫性)3:18,2003),其每一个通过参考完全并入本申请中。两种表位的C末端都可以通过体外蛋白酶体消化而有效地产生。来自SSX-2阳性患者的肿瘤-渗透性淋巴结的分离的HLA-A*0201/SSX-241-49多聚体+CD8+T细胞表现出高度的功能亲和力,并且可以有效地识别SSX-2阳性肿瘤;然而,自发发生的免疫应答不足以使肿瘤停止生长,可能是由于这些免疫应答直到疾病进展的相当晚期才发展,并且所活化的T细胞不是足够多。美国专利号6,548,064(其通过参考完全并入本申请中)进一步描述了在SSX-2表位的P2和PΩ位置取代T或A残基。
NY-ESO-1是在广泛种类的肿瘤中发现的睾丸癌抗原,并且还叫作CTAG-1(睾丸癌症抗原-1)和CAG-3(癌症抗原-3)。作为肿瘤-相关抗原(TuAA)的NY-ESO-1在美国专利5,804,381中公开,其题目为“ISOLATEDNUCLEIC ACID MOLECULE ENCODING AN ESOPHAGEAL CANCERASSOCIATED ANTIGEN,THE ANTIGEN ITSELF,AND USESTHEREOF”(“编码食道癌症相关抗原的分离的核酸分子,抗原本身,及其应用”),通过参考完全并入本申请中。编码具有广泛的序列同一性的抗原的旁系同源基因座,LAGE-1a/s和LAGE-1b/L,已经在人类基因组的公众可用汇编中公开,并且推论其通过交替剪接(alternate splicing)而产生。另外,CT-2(或CTAG-2,睾丸癌症抗原-2)似乎是LAGE-1b/L的等位基因、突变体、或测序偏差(sequencing discrepancy)。由于广泛的序列同一性,许多来自NY-ESO-1的表位还可以诱导针对表达这些其它抗原的肿瘤的免疫性。所述蛋白到氨基酸70实质上是相同的。从残基71-134,NY-ESO-1和LAGE之间最长的同一性是6个残基,但是存在潜在的交叉反应序列。从残基135-180,除了单个残基外,NY-ESO和LAGE-1a/s是相同的,但是由于交替剪接,LAGE-1b/L是不相关的。CAMEL和LAGE-2抗原似乎衍生于LAGE-1mRNA,但是衍生于改变的阅读框,因此产生不相关的蛋白序列。最近,GenBank登记号AF277315.5,人染色体X克隆RP5-865E18,RP5-1087L19,完整序列,其通过引用完全结合于此,报道了这一区域中的3个独立的基因座,其标记为LAGE1(在基因组集合中与CTAG-2相对应),加上LAGE2-A和LAGE2-B(在基因组集合中二者与CTAG-1相对应)。
在题目为“ISOLATED NUCLEIC ACID MOLECULE ENCODINGCANCER ASSOCIATED ANTIGEN,THE ANTIGEN ITSELF,AND USESTHEREOF”(“编码癌症相关抗原的分离的核酸分子,抗原本身,及其应用”)的美国专利号6,274,145中,将NY-ESO-1157-165鉴定为HLA-A2限制性表位,并且题目为“EPITOPE SEQUENCES”(“表位序列”)的美国专利申请号10/117,937(公布号20030220239)报道了这种C末端是在体外检测中通过看家蛋白酶体而产生的。单独地在PΩ取代A,V,L,I,P,F,M,W,或G,或与另一位置的A组合的类似物,在美国专利号6,417,165和6,605,711中公开,二者题目皆为“NY-ESO-1-PEPTIDE DERIVATIVES AND USESTHEREOF”(“NY-ESO-1-肽衍生物及其应用”)。本段所述的每一参考文献通过引用全部并入本申请中。
PRAME,还叫作MAPE、DAGE、和OIP4,最初观察为黑素瘤抗原。后来,它被公认为CT抗原,但是不同于许多CT抗原(例如,MAGE、GAGE、和BAGE),它在急性髓细胞样白血病中表达。PRAME是MAPE家族的一员,MAPE家族主要由同PRAME具有有限的序列相似性的假定的蛋白组成。PRAME作为TuAA的用途在美国专利号5,830,753中教导,其题目为“ISOLATED NUCLEIC ACID MOLECULES CODING FOR TUMORREJECTION ANTIGEN PRECURSOR DAGE AND USES THEREOF”(“编码肿瘤排斥抗原前体DAGE的分离的核酸分子及其应用”),其通过参考全部并入本申请中。美国专利申请号10/181,499(公布号:US2003-0186355 A1),题目为“METHODS FOR SELECTING ANDPRODUCING T CELL PEPTIDE EPITOPES AND VACCINESINCORPORATING SAID SELECTED EPITOPES”(“选择和生产T细胞肽表位的方法和结合所选表位的疫苗”)(其通过参考全部并入本申请中),应用免疫蛋白酶体的体外消化,鉴定了许多潜在的表位,包括PRAME425-433。
PSMA(前列腺-特异性膜抗原),在题目为“PROSTATE-SPECIFICMEMBRANES ANTIGEN”(“前列腺-特异性膜抗原”)的美国专利5,538,866中描述的TuAA,是由正常的前列腺上皮细胞所表达的,并且在前列腺癌中以更高的水平表达,所述美国专利5,538,866通过参考全部并入本申请中。它还在非前列腺肿瘤的新血管系统中被发现。因此,PSMA可以形成针对前列腺癌和针对其它肿瘤的新血管系统的疫苗的基础。后一观点在下列各项中更充分地描述:美国专利公布号20030046714;PCT公布号WO 02/069907;和临时美国专利申请号60/274,063,题目为“ANTI-NEOVASCULAR VACCINES FOR CANCER”(“用于癌症的抗-新血管系统疫苗”),其于2001年3月7日提交,以及美国申请号10/094,699(公布号:US 2003-0046714 A1),其于2002年3月7日提交,题目为“ANTI-NEOVASCULAR PREPARATIONS FOR CANCER”(“用于癌症的抗-新血管系统制剂”),上述每一项通过参考全部并入本申请中。在所述出版物和申请中公开的教导和实施方案提供与本发明相关的并且有效与本发明联系的支持原理和实施方案。简要地,由于肿瘤生长,它们恢复了新血管的向内生长。由于未血管化的肿瘤中心通常是坏死的,并且已经报道血管生成抑制剂引起肿瘤消退,所以这被理解为是维持生长所必需的。这样的新血管或新血管系统,表达在已建立的脉管中没有发现的抗原,并且因此可以被特异性地靶向。通过诱导针对新生血管抗原的CTL,所述血管可以被破坏,这中断了营养向肿瘤的流动(并且从肿瘤移除废物),引起肿瘤的消退。
PSMA mRNA的交替剪接还导致在Met58的具有明显的起点的蛋白,由此删除推定的PSMA膜锚定区域,如在美国专利5,935,818中所描述的那样,所述专利题目为“ISOLATED NUCLEIC ACID MOLECULEENCODING ALTERNATIVELY SPLICED PROSTATE-SPECIFICMEMBRANES ANTIGEN AND USES THEREOF”(“编码选择剪接的前列腺-特异性膜抗原的分离的核酸分子及其应用”),其通过参考完全并入本申请中。叫作PSMA样蛋白的蛋白,Genbank登记号AF261715,其通过参考完全并入本申请中,几乎同PSMA的氨基酸309-750一致,并且具有不同的表达模式。因此,更优选的表位是那些具有位于氨基酸58-308的N端的表位。在WO 01/62776中,PSMA288-297被确定为具有HLA-A2结合基序,所述WO 01/62776题目为“HLA BINDING PEPTIDES ANDTHEIR USES”(“HLA结合肽与它们的应用”),其通过参考完全并入本申请中。它在体外用看家蛋白酶体消化产生并且实际上与HLA-A2结合,在题目为“EPITOPE SEQUENCES”(“表位序列”)的美国专利申请公布号20030220239中公开。
酪氨酸酶是黑色素生物合成酶,其被认为是黑素细胞分化的最特异的标记之一。酪氨酸酶在很少的细胞类型中表达,主要在黑素细胞中表达,并且高水平通常在黑素瘤细胞发现。酪氨酸酶作为TuAA的用途在美国专利5,747,271中教导,其题目为“METHOD FOR IDENTIFYINGINDIVIDUALS SUFFERING FROM A CELLULAR ABNORMALITYSOME OF WHOSE ABNORMAL CELLS PRESENT COMPLEXES OFHLA-A2/TYROSINASE DERIVED PEPTIDES,AND METHODS FORTREATING SAID INDIVIDUALS”(“鉴定患有细胞异常的个体的方法,其中一些异常细胞呈递HLA-A2/酪氨酸酶衍生的肽复合体,以及治疗所述个体的方法”),其通过参考完全并入本申请中。
Melan-A,也叫作MART-1(T细胞识别的黑素瘤抗原),是在黑素瘤中以高水平表达的另一种黑色素生物合成蛋白。Melan-A/MART-1作为TuAA的用途在美国专利号5,874,560和5,994,523中教导,二者题目皆为“MELANOMA ANTIGENS AND THEIR USE IN DIAGNO STIC ANDTHERAPEUTIC METHODS”(“黑素瘤抗原及其在诊断和治疗方法中的应用”),以及在美国专利号5,620,886中教导,其题目为“ISOLATEDNUCLEIC ACID SEQUENCE CODING FOR A TUMOR REJECTIONANTIGEN PRECURSOR PROCESSED TO AT LEAST ONE TUMORREJECTION ANTIGEN PRESENTED BY HLA-A2”(“编码被加工成至少一种由HLA-A2呈递的肿瘤排斥抗原的肿瘤排斥抗原前体的分离的核酸序列”),所有这些通过参考完全并入本申请中。来源于这种TuAA的免疫显性HLA-A2限制性表位是Melan-A26-35。已表明它是由看家蛋白酶体产生的(Morel,S.等.Immunity(免疫性)12:107-117,2000,其通过参考完全并入本申请中)。结合标准氨基酸的各种类似物,包括在P2取代L的改善的类似物,在美国专利号6,025,470中公开,其题目为“ISOLATED NONA-AND DECAPEPTIDES WHICH BIND TO HLA MOLECULES,AND THEUSE THEREOF(“结合HLA分子的分离的九-和十肽,及其应用”)”,其通过参考完全并入本申请中。结合非标准氨基酸的类似物的应用,其具有改善生化稳定性的基本目的,由Blanchet,J.-S.等.,J.Immunol.(免疫学杂志)167:5852-5861,2001报道,其通过参考完全并入本申请中。
SSX-241-49类似物
如上文提及,癌症患者中针对SSX-2的天然免疫应答,包括针对SSX-241-49的应答,可能不会有效地控制癌症。另外,野生型SSX-241-49只是中等免疫原性肽,这可能进一步限制它的临床潜力。由应用超拮抗剂类似物诱导的更强的SSX-2特异性免疫应答对患有SSX-2阳性肿瘤的患者产生临床益处。
因此,在一个实施方案中,所述类似物可以用在刺激受试者的免疫应答的组合物中,以增加针对显示靶点抗原的靶细胞的免疫应答。所述实施方案可具有在治疗和预防致瘤性和病毒性疾病中的用途。
由于野生型SSX-241-49只是中等免疫原性肽,这可能会妨碍它在体内有效地消除肿瘤,所以应用一种方法重新设计更有效或具有许多改善的特性的SSX-241-49变体。通过应用更有免疫原性的SSX-2类似物肽,可能刺激更强的免疫应答和/或增强天然发生的免疫应答,以获得更好的临床反应时机。因此,对于每种类似物,分析与野生型表位的结合特性(亲和力和HLA-A*0201/肽复合体稳定性)、免疫原性、抗原性和交叉反应性,以确定改善的特性。在一些实施方案中,改善的特性一般意指,对于某些目的,所述类似物可以比野生型更好地应用。因此,所述类似物不必展现出改善的结合、稳定性、或要被改善的活性,并且甚至可以表现出减少的调控所述过程的某些部分的能力,但是对于其它方式的应用仍然是改善的。例如,在耐受野生型抗原的人体系统中,保留某些活性但不是全部活性的类似物,可能更好。
以前,通过结合有利的锚定残基修饰天然肿瘤-相关的肽表位产生了具有改善的与HLA分子的结合模式和增强的免疫原性的类似物。最成功的实例之一是Melan-A 26-35表位的A27L肽类似物。Valmori等.,″Enhanced generation of specific tumor-reactive CTL in vitro by selectedMelan-A/MART-1 immunodominant peptide analogs,″(“通过选择的Melan-A/MART-1免疫显性肽类似物增强特异性肿瘤-反应性CTL在体外的产生”)J Immunol.(免疫学杂志)1998,160(4):1750-8;其通过参考完全并入本申请中。由于它在位置2缺少最佳的锚定氨基酸残基,最初的表位没能与HLA-A2分子形成稳定的复合体。修饰的A27L Melan A 26-35肽类似物明确地显示出增加的与HLA-A2分子的结合模式和比其野生型负体更强的免疫原性。用这一类似物免疫患者可以产生能够识别在细胞表面呈递的野生型表位的强T细胞免疫应答。已经成功地获得了相似的修饰,其具有许多其它肿瘤相关的表位,诸如GP100 209-217(Parkhurst等.,″Improved induction of melanoma-reactive CTL with peptides from themelanoma antigen gp100 modified at HLA-A*0201-binding residues,″(“使用来源于在HLA-A*0201-结合残基修饰的黑素瘤抗原gp100的肽提高黑素瘤-反应性CTL的诱导”)J Immunol.(免疫学杂志)1996,157(6):2539-48;其通过参考完全并入本申请中),和Her-2369-377(Vertuani等.,″Improvedimmunogenicity of an immunodominant epitope of the HER-2/neuprotooncogene by alterations of MHC contact residues,″(“通过改变MHC接触残基提高HER-2/neu原癌基因的免疫显性表位的免疫原性”)J Immunol.(免疫学杂志)2004,172(6):3501-8;其通过参考完全并入本申请中)。
本文公开可以用于鉴定并且产生滑膜肉瘤X断裂点2(SSX-2)野生型序列的类似物的方法。应用本文公开的方法,鉴定了一组95种基于氨基酸241-249的野生型序列的新SSX-241-49类似物,其具有各种改善的特性。所述改善的特性包括,但不限于,与I类MHC和T细胞受体(TCR)分子的结合,和生物反应,诸如IFN-γ分泌、细胞毒性,和肿瘤细胞裂解。还鉴定了具有改善的效力的肽,其保持与野生型表位的交叉反应性。在这些类似物中,一些已经证明是野生型SSX-241-49肽的超拮抗剂变体,其中的一些已经显示出具有同HLA-A*0201分子高得多的亲和力,并且所述肽-HLA复合体具有扩大的稳定性。这些类似物在使用它们进行免疫的HHD转基因小鼠中诱导增强的CTL免疫应答。所获得的CTLs可以有效地在体内和体外裂解A2+和SSX-2+肿瘤细胞系,这表明应用所述类似物产生的CTLs能够识别在细胞表面天然呈递的野生型SSX-241-49表位。与野生型SSX-241-49表位相比较,所述类似物是研发癌症疫苗的更好的候选物。
因此,本发明公开的实施方案包括长度为9或10个氨基酸的一种或多种肽的家族,序列上与人睾丸癌(CT)抗原SSX-2的氨基酸41-49(SSX-241-49)相关。个体肽实施方案具有在野生型序列中的一至多个确定的氨基酸取代。所取代的氨基酸不同地为通常遗传编码的标准系列氨基酸的其它成员,其衍生物,其D-立体异构体,或其它非标准L-氨基酸。这些类似物用于研究野生型表位与I类MHC和TCR分子以及免疫应答其它成分之间的相互作用,并且用于设计具有进一步优化的免疫学特性的其它类似物。在检验它们的HLA-转基因小鼠模型中,所述类似物的一些实施方案具有至少与野生型表位相似的免疫学特性。由于SSX-2是自体抗原,针对其可以预测一定程度的耐受性,并且类似物的氨基酸差异可以帮助刺激T细胞群体,所述T细胞群体避免了阴性选择但是与野生型表位交叉反应,所以这样的肽可以用于人体。许多肽实施方案可以具有一种或多种改善的免疫学特性,因为它们具有对于MHC的更大的亲和力或更大的与MHC结合的稳定性,激发更多的细胞因子产生或需要更低的肽浓度来激发从识别野生型表位的T细胞产生相似的细胞因子,它们更有免疫原性,可以诱导或增强对野生型表位的交叉反应性细胞溶解反应,和/或可以破坏耐受性。
在一个实施方案中,所述类似物可以在选自由P1、P2、P4、P6、P8、P9和P10组成的组的残基具有至少一个取代。在另一个实施方案中,所述类似物可以在选自由P1、P2、P4、P6、P8、P9和P10组成的组的残基具有至少两个取代。在另一个实施方案中,所述类似物可以在选自由P1、P2、P4、P6、P8、P9和P10组成的组的残基具有至少3个取代。在另一个实施方案中,所述类似物可以具有在位置P2和P9的取代。在另一个实施方案中,所述肽可以具有在残基P1、P2和P9的取代。在另一个实施方案中,所述肽类似物可以具有在残基P1、P2和P4的取代。在另一个实施方案中,所述肽类似物可以具有在残基P1、P2和P6的取代。在另一个实施方案中,所述肽类似物可以具有在残基P1、P2和P8的取代。在一个实施方案中,两种取代可以产生改善的特性。在另一个实施方案中,一种取代可以产生改善的特性。在另一个实施方案中,三种取代可以产生改善的特性。在另一个实施方案中,一种或多种取代可以产生改善的特性,但是仍然可以被识别野生型序列的TCR识别(仍然与野生型序列交叉反应)。
一个实施方案涉及表位阵列和其它包括可以被加工以释放所述类似物的表位类似物序列的多肽。其它实施方案涉及编码所述多肽的核酸,特别是DNA质粒,或只是类似物,及其从所述核酸的表达。所述类似物、包括它们的多肽、以及所述编码的核酸可以都是免疫原性组合物的成分,特别是适于淋巴内递送的组合物的成分,这组成了其它的实施方案。
类似物设计
实施方案涉及SSX-241-49肽,其含有序列KASEKIFYV(SEQ ID NO.1)的取代(参见图1)。在另一个实施方案中,所述类似物通常可以是具有序列KASEKIFYVY(SEQ ID NO.1)的SSX-241-50十聚体肽的类似物。组成所述肽的残基或氨基酸在本文中称为P1-P9或P1-P10,以指明在肽内按照从N-到C-端编号的位置,在九聚体中P1对应N端的赖氨酸,和P9对应C端的缬氨酸。备选地,所述残基可以通过它们涉及的分子的主要活性而指示。例如,残基P2描述为N端一级锚定分子,而P9(或者在十聚体中的P10)描述为一级C端锚点。残基P4,P6和P8主要参与TCR相互作用。取代可以应用任何氨基酸,包括标准氨基酸和非标准氨基酸,这对本领域的技术人员是已知的。本申请公开了许多示例性氨基酸,然而,本申请所公开的取代不必意指包括所有的设想取代的列表,而是可能的取代的示例。本领域的技术人员可以在目录和参考文献中找到许多其它非标准的氨基酸,其可以购买或化学产生,以与本申请的类似物一起使用。
许多可能的类似物通过修饰肽锚定残基而产生,以获得更好的HLA结合模式和更高的免疫应答,其包括在N端一级锚点(anchor)(P2位置),在N端二级锚点(P1位置),在N端一级和二级锚点(P1和P2位置),和在N端一级/二级锚点(P1和P2位置)以及C端一级锚点(P9位置)。并且,产生具有在锚定残基和TCR接触残基的修饰的肽,以防止T细胞对自身抗原的耐受性,这些修饰包括在N端一级/二级锚点(P1和P2位置)和二级TCR识别位点(P4、P6和/或P8位置)的修饰,在N端一级/二级锚点(P1和P2位置)的修饰,和在C端一级锚点(P9)以及在二级TCR识别位点(P4、P6和/或P8位置)的修饰。并且,产生了十聚体类似物。
哪种残基将最好地产生具有改善的特性的类似物的选择包括对MHC肽相互作用的研究、TCR肽相互作用和本领域已知的先前的类似物的分析。一些残基主要参与具体的相互作用,并且一些是次要地或者甚至是三级地参与。因此,所述残基怎样参与这些分子的结合的知识涉及所述分析。并且,优选一些野生型残基,意味着它们很好地进行所需要的相互作用;而其它不是优选的,意味着它们极差地进行相互作用。因此,在一个实施方案中,非优选的残基可以被取代。例如,在C端的缬氨酸通常是优选的锚定残基,由于它产生与HLA分子的强相互作用,并且因此,更少优选取代这一残基。然而,通过结合有利的锚定残基而修饰野生型肿瘤-相关的肽表位已经产生了具有与HLA分子改善的结合模式和增强的免疫原性的类似物。最成功的实例之一是Melan-A 26-35表位的A27L肽类似物(Valmori D,等.J Immunol.(免疫学杂志)160(4):1750-8,1998;其通过参考完全并入本申请中)。由于它在位置2缺少最适锚定残基,初始表位没能与HLA-A2分子形成稳定的复合体。相反,修饰的Melan A26-35 A27L肽类似物明确地表现出与HLA-A2分子增加的结合模式和比其野生型负体更高的免疫原性。用这种类似物免疫患者产生能够识别在细胞表面存在的野生型表位的强T细胞免疫应答。成功地获得了相似的修饰,其具有许多其它肿瘤-相关的表位,诸如GP100 209-217(Parkhurst MR,等.,JImmunol.(免疫学杂志)157(6):2539-48,1996;其通过参考完全并入本申请中),Her-2 369-377(Vertuani S,等.,J Immunol.(免疫学杂志)172(6):3501-8,2004;其通过参考完全并入本申请中)。
有多少残基要取代的选择包括这样的要求,即,取代更好的残基,但是仍然保留足够的表位性质,以便它仍然将被识别野生型表位的T细胞而识别。因此,在一个实施方案中,可以对野生型肽进行一种和两种取代。在另一个实施方案中,可以对野生型肽进行多于两种的取代,而仍然保留与野生型肽的交叉反应性。
一般地,理想地取代参与TCR识别的肽的部分,以产生改善的免疫原性,而仍然与野生型表位交叉反应。在一个实例中,优选表现出增加的免疫原性的肽。由于据信P2位置或在N末端的第二个氨基酸主要参与主要通过改善的结合特性产生改善的免疫原性的过程,所以它是优选的取代位点,并且在示例性类似物中进行了许多修饰,以鉴定理想的取代。相似的考虑应用到羧基端位置,PΩ,其对于MHC结合也是重要的。
因此,在一个实施方案中,所述类似物可以包括在P2残基的取代,其用更加疏水性的残基取代野生型丙氨酸。在另一个实施方案中,所述疏水性残基还可以具有更大的侧链。在另一个实施方案中,在P1的残基可以用更加疏水的残基取代。在另一个实施方案中,残基P1和P2都可以用更加疏水的残基取代。其它实施方案中,在P1、P2、和P9的至少一个残基可以被取代。在另一个实施方案中,在P1、P2、和P9的至少两个残基可以被取代。在另一个实施方案中,在P1、P2、P9、P4和P6的至少两个残基可以被取代,包括参与TCR结合的一个或多个残基。
在一些实施方案中,取代那些仅次要地参与同TCR或MHC分子结合的残基可以是有利的。例如,取代次要的TCR结合氨基酸可以产生这样的类似物,即,其仍然结合并且产生应答,并不妨碍与MHC分子的结合,但是优选地克服自身抗原的耐受组织。由于患有癌症的患者可以部分地耐受所述抗原,所以这是有用的。因此,为了克服所述耐受性,保留一些活性的类似物可以优选地为具有改善的免疫原性的类似物,原因在于它将被免疫系统识别为“自身”的可能性更少。
除了取代在多个确定的指定表位位置的氨基酸之外,长度变体也可以用作类似物。最典型地,从肽的一端、另一端或两端加上或移除额外的氨基酸残基。在一些实例中,加上的末端残基在施用给受试者之后通过蛋白水解去除,在与MHC结合之前重新生成指定的表位或相同长度的类似物。在其它情形中,改变长度的肽是真正抗原性交叉反应的,如在实施例20中所述,或通过Melan-A27-35和Melan-A26-35之间的关系而示例。应该理解,特别包括或排除在这些加上的末端位置(在本文中的一些地方叫作P0和PΩ+1)的任何位置的任何具体氨基酸的个体实施方案在本文公开的本发明的范围之内。当说某种类似物基本上由某种序列组成时,应该理解这需要被剪截或者保留交叉反应性的这样长度短的变体。在一些实施方案中,插入更小的氨基酸(例如,甘氨酸、丙氨酸或丝氨酸),特别是在锚定位置之间,可以与在TCR-相互作用残基中的改变相似地作用。
1.N端近端一级锚点修饰(P2)
N端一级锚点是肽的第二个N端氨基酸,并且是N端近端一级锚点。它主要参与与MHC分子的相互作用,并且取代可以导致改善的结合和稳定性。然而,它还可以次要地参与TCR相互作用。因此,在这一位点的取代可以形成具有与MHC分子改善的相互作用以及与TCR改善的相互作用的肽。
通常,据信对于与MHC分子相互作用,在野生型序列的这一位置发现的丙氨酸是非优选的。因此,所述类似物的优选的实施方案具有在这一位置的取代。在一个实施方案中,野生型序列中初始发现的Ala 42可以用更加疏水性的氨基酸取代。可以应用任何更加疏水性的氨基酸,包括任何可用的或为本领域的技术人员已知的,包括标准氨基酸和非标准氨基酸。在另一个实施方案中,初始Ala 42用还具有大侧链的更加疏水性的氨基酸取代。更加疏水性的氨基酸的实例包括,但不限于:Leu、Val、Ile、Met、α-氨基丁酸、正亮氨酸和正缬氨酸。表1是N-端近端一级锚点修饰和每一修饰的结果的总结。
表1
N端近端一级锚点修饰
| 种类 | 肽名 | 序列 | SEQ IDNO. | 预测得分(R/NIH) | 半最大结合(mM) | 相对亲和力(1/RA) | 稳定性(T1/2)(小时) | 交叉反应性和fct亲和力(类似物固有)* |
| 天然肽 | SSX2 41-49 | KASEKIFYV | 1 | 22/1017 | 14.64 | 1.0 | 11 | 1 |
| N-端一级锚点 | SSX2 41-49(A42L) | KLSEKIFYV | 102 | 28/73228 | 8.89 | 1.6 | 19 | 0.03 |
| SSX2 41-49(A42V) | KVSEKIFYV | 103 | 22/6407 | 5.2 | 2.8 | 20 | 0.03 | |
| SSX2 41-49(A42I) | KISEKIFYV | 104 | 26/10068 | 8.8 | 1.7 | 22.5 | 3 | |
| SSX2 41-49(A42M) | KMSEKIFYV | 105 | 26/52887 | 8.8 | 1.7 | 22.5 | 0.1 | |
| SSX2 41-49(A42(D-Ala)) | K(D-Ala)SEKIFYV | 106 | NA | N/B | N/B | N/B | 10 | |
| SSX2 41-49(A42(D-Leu)) | K(D-Leu)SEKIFYV | 107 | NA | N/B | N/B | N/B | N/T | |
| SSX2 41-49(A42(D-Val)) | K(D-Val)SEKIFYV | 108 | NA | N/B | N/B | N/B | 3 | |
| SSX2 41-49(A42(Nal-1)) | KNal-1SEKIFYV | 109 | NA | N/B | N/B | N/B | >10 | |
| SSX2 41-49(A42(Nal-2)) | KNal-2SEKIFYV | 110 | NA | 13.9 | 1.1 | N/A | 3 | |
| SSX2 41-49(A42(Abu)) | KAbuSEKIFYV | 111 | NA | 7.56 | 1.9 | N/A | 0.3 | |
| SSX2 41-49(A42(Nle)) | KNleSEKIFYV | 112 | NA | 5.82 | 2.5 | 24 | 0.1 | |
| SSX2 41-49(A42(Nva)) | KNvaSEKIFYV | 113 | NA | 11.4 | 1.3 | N/A | 0.1 |
| 种类 | 肽名 | 序列 | SEQ IDNO. | 预测得分(R/NIH) | 半最大结合(mM) | 相对亲和力(1/RA) | 稳定性(T1/2)(小时) | 交叉反应性和fct亲和力(类似物固有)* |
| SSX2 41-49(A42(Aib)) | KAibSEKIFYV | 114 | NA | 18.4 | 0.8 | N/A | 3 |
2.N端二级锚点修饰(P1)
N端二级锚点是在N端的第一个氨基酸。这一残基是Lys 41,并且定义为与HLA-A*0201分子相互作用中的二级锚定残基。然而,它还在某种程度上参与与T细胞受体的相互作用。因此,这一位置的修饰可以产生一些更有免疫原性并且更适于研发肿瘤疫苗的不规则的类似物。尽管通常认为在这一位置赖氨酸是有利的,但是取代可以导致高度改善的特性。
因此,在一个实施方案中,在野生型序列中发现的初始Lys 43可以用更加疏水的氨基酸取代。可以应用任何更加疏水的氨基酸,包括任何可用的或本领域的技术人员已知的,包括标准氨基酸和非标准氨基酸。在另一个实施方案中,Lys 43可以用芳香氨基酸取代。更加疏水的氨基酸的实例包括,但不限于:Phe、Tyr、Trp、和D-Lys。表2是N-端二级锚点修饰和每一修饰的结果的总结。
表2
N端二级锚点修饰
| 种类 | 肽名 | 序列 | SEQIDNO. | 预测得分(R/NIH) | 半最大结合(mM) | 相对亲和力(1/RA) | 稳定性(T1/2)(小时) | 交叉反应性和fct亲和力(类似物固有)* |
| 天然的 | SSX2 41-49 | KASEKIFYV | 1 | 22/1017 | 14.64 | 1.0 | 11 | 1 |
| N-端二级锚点 | SSX2 41-49(K41F) | FASEKIFYV | 115 | 23/1336 | 9.55 | 1.5 | >24 | 0.3 |
| SSX2 41-9(K41W) | WASEKIFYV | 116 | 22/1336 | 27.07 | 0.5 | N/A | >10 | |
| SSX2 41-49(K41Y) | YASEKIFYV | 117 | 21/1336 | 8.74 | 1.7 | >24 | 3 | |
| SSX2 41-49(K41(D-Lys)) | (D-Lys)ASEKIFYV | 118 | NA | N/B | N/B | N/B | >10 | |
| SSX2 41-49(K41(Phg)) | PhgASEKIFYV | 119 | NA | 5.83 | 2.5 | >24 | 0.1 | |
| SSX2 41-49(K41(Cha)) | ChaASEKIFYV | 120 | NA | N/B | N/B | N/B | >10 | |
| SSX2 41-49(K41(Phe-4F)) | Phe(4-F)ASEKIFYV | 121 | NA | 6.72 | 2.2 | >24 | 3 | |
| SSX2 41-49(K41(Phe-4NO2)) | Phe(4-NO2)ASEKIFYV | 122 | NA | 12.8 | 1.1 | N/A | 3 | |
| SSX2 41-49(K41(O-甲基Tyr)) | O-甲基-TyrASEKIFYV | 123 | NA | 19.5 | 0.8 | 20 | 3 | |
| SSX2 41-49(K41(b-(3-方面并噻吩基)Ala)) | b-(3-苯并噻吩基)AlaASEKIFYV | 124 | NA | 24.1 | 0.6 | N/A | 10 |
3.N端一级和二级修饰(P2和P1)
在一个实施方案中,一级和二级锚定残基都被取代,而导致对HLA分子提高的结合亲和力。在另一个实施方案中,所述双取代产生与HLA分子结合的提高的稳定性。其它实施方案中,结合和/或稳定性没有提高,并且甚至可以被减小,但是改善了所述分子的其它特性,诸如活性或被耐受个体的识别。表3是N-端一级和二级锚点修饰和每一修饰的结果的总结。
表3
N端一级和二级锚点修饰
| 种类 | 肽名 | 序列 | SEQ IDNO. | 预测得分(R/NIH) | 半最大结合(mM) | 相对亲和力(1/RA) | 稳定性(T1/2)(小时) | 交叉反应性和fct亲和力(类似物固有)* |
| 天然的 | SSX2 41-49 | KASEKIFYV | 1 | 22/1017 | 14.64 | 1.0 | 11 | 1 |
| N-端一级/二级锚点 | SSX2 41-49(K41Y,A42L) | YLSEKIFYV | 125 | 29/96243 | 11.8 | 1.2 | >24 | N/T |
| SSX2 41-49(K41Y,A42V) | YVSEKIFYV | 126 | 23/8421 | 14.6 | 1.0 | >24 | 0.1 | |
| SSX2 41-49(K41Y, | YMSEKIFYV | 127 | 27/69508 | 25 | 0.6 | >24 | 3 |
| 种类 | 肽名 | 序列 | SEQ IDNO. | 预测得分(R/NIH) | 半最大结合(mM) | 相对亲和力(1/RA) | 稳定性(T1/2)(小时) | 交叉反应性和fct亲和力(类似物固有)* |
| A42M) | ||||||||
| SSX2 41-49(K41Y,A42I) | YISEKIFYV | 128 | 27/13233 | 6.5 | 2.3 | N/A | 1 | |
| SSX2 41-49(K41F,A42L) | FLSEKIFYV | 129 | 28/96243 | 4.9 | 3.0 | >24 | 0.3 | |
| SSX2 41-49(K41F,A42V) | FVSEKIFYV | 130 | 22/8421 | 4.675 | 3.1 | 24 | 0.1 | |
| SSX2 41-49(K41F,A42M) | FMSEKIFYV | 131 | 26/69508 | 6.58 | 2.2 | >24 | 3 | |
| SSX2 41-49(K41F,A42I) | FISEKIFYV | 132 | 26/13233 | 5.368 | 2.7 | >24 | 0.3 | |
| SSX2 41-49(K41W,A42L) | WLSEKIFYV | 133 | 27/96243 | 4.472 | 3.3 | >24 | 0.3 | |
| SSX2 41-49(K41W,A42V) | WVSEKIFYV | 134 | 21/8421 | 4.82 | 3.0 | >24 | 1 | |
| SSX2 41-49(K41W,A42M) | WMSEKIFYV | 135 | 25/69508 | 5.13 | 2.9 | >24 | 1 | |
| SSX2 41-49(K41W,A42I) | WISEKIFYV | 136 | 25/13233 | 6.98 | 2.1 | >24 | 0.1 | |
| SSX2 41-49(K41(D-Lys),A42L) | (D-Lys)LSEKIFYV | 137 | N/A | 2.5 | 5.9 | 15 | 10 | |
| SSX2 41-49(K41(D-Lys)A42V) | (D-Lys)VSEKIFYV | 138 | N/A | 24.5 | 0.6 | N/A | 10 |
4.N端一级/二级锚点和C端一级修饰(P2,P1和P9)
野生型肽的C端Val通常是优选的锚定残基,并且主要参与同MHC分子的相互作用。然而,进行取代,以确定哪个氨基酸改善了具有一级和二级N端修饰的类似物。在不存在一种或多种N端修饰时,也可以应用这些C端取代。
这些修饰表现出提高的结合亲和力和稳定性,并且在一些情形中,导致具有减少的交叉反应性的类似物。因此,在一些实施方案中,对C端的取代导致具有提高的结合和/或稳定性而没有减少的交叉反应性的肽。然而,在其它实施方案中,对C端的取代导致具有提高的结合和/或稳定性具有相等的或减少的交叉反应性的肽。每种分子可以在特定情形中或在特定患者中应用。在一个实施方案中,将C端的缬氨酸用大的脂族氨基酸取代。表4是N-端一级/二级锚点和C端一级修饰和每一修饰的结果的总结。
表4
N端一级/二级锚点和C端一级修饰
5.N端一级/二级锚点和TCR残基修饰
TCR位点通常认为是残基P4、P6、和P8,并且是参与结合TCR的主要残基。然而,其它残基也可以较少程度地参与相互作用。在一个实施方案中,可以取代主要参与TCR相互作用的一个或多个位点以增加相互作用。优选地,这些取代可以产生不规则的类似物,所述类似物不妨碍与MHC分子结合,但是克服野生型肽的耐受问题。在另一个实施方案中,可以包括至少一种TCR取代,其在位置P1、P2、和/或P9具有至少一个取代。在另一个实施方案中,在P4、P6、和P8位置的任何一个或多个的取代可以是极性氨基酸。在另一个实施方案中,所述取代可以是在位置P8的芳香族氨基酸。在另一个实施方案中,所述取代可以是在位置P6的具有大的脂族侧链的氨基酸。在另一个实施方案中,所述取代可以是具有更大的侧链以维持(preserve)相互作用的氨基酸。表5是N-端一级/二级锚点和TCR残基修饰以及每一修饰的结果的总结。
表5
N端一级/二级锚点和TCR位点修饰
| 种类 | 肽名 | 序列 | SEQIDNO. | 预测得分(R/NIH) | 半最大结合(mM) | 相对亲和力(1/RA) | 稳定性(T1/2)(小时) | 交叉反应性和fct亲和力(类似物固有)* |
| 天然的 | SSX2 41-49 | KASEKIFYV | 1 | 22/1017 | 14.64 | 1.0 | 11 | 1 |
| N-端一级/二级锚点,TCR位点 | SSX2 41-49(K41F,A42V,E44D) | FVSDKIFYV | 152 | 21/8421 | 13.18 | 1.1 | N/A | >10 |
| SSX2 41-49(K41F,A42V,E44N) | FVSNKIFYV | 153 | 20/2054 | 8.97 | 1.6 | N/A | >10 | |
| SSX2 41-49(K41F,A42V,E44S) | FVSSKIFYV | 154 | 20/2054 | 17.5 | 0.8 | N/A | >10 | |
| SSX2 41-49(K41F,A42V,E44T) | FVSTKIFYV | 155 | 20/2054 | 12.94 | 1.1 | N/A | >10 | |
| SSX2 41-49(K41F,A42V,E44Q) | FVSQKIFYV | 156 | 20/2054 | 40.8 | 0.4 | N/A | 10 |
| 种类 | 肽名 | 序列 | SEQIDNO. | 预测得分(R/NIH) | 半最大结合(mM) | 相对亲和力(1/RA) | 稳定性(T1/2)(小时) | 交叉反应性和fct亲和力(类似物固有)* |
| SSX2 41-49(K41F,A42V,E44Nle) | FVS(Nle)KIFYV | 157 | N/A | 13 | 1.1 | N/A | 10 | |
| SSX2 41-49(K41F,A42V,E44Nva) | FVS(Nva)KIFYV | 158 | N/A | 3.8 | 3.9 | >24 | 3 | |
| SSX2 41-49(K41F,A42V,I46L) | FVSEKLFYV | 159 | 22/8421 | 7.8 | 1.9 | 24 | 3 | |
| SSX2 41-49(K41F,A42V,I46V) | FVSEKVFYV | 160 | 22/8421 | N/A | N/A | 24 | 1 | |
| SSX2 41-49(K41F,A42V,I46M) | FVSEKMFYV | 161 | 18/8421 | 9.2 | 1.6 | 22 | >10 | |
| SSX2 41-49(K41F,A42V,46Nle) | FVSEK(Nle)FYV | 162 | N/A | 12.8 | 1.1 | 19 | 10 | |
| SSX2 41-49(K41F,A42V,I46Nva) | FVSEK(Nva)FYV | 163 | N/A | 6.21 | 2.4 | >24 | 1 | |
| SSX2 41-49(K41F,A42V,Y48T) | FVSEKIFTV | 164 | 24/1531 | 3.9 | 3.8 | 24 | >10 | |
| SSX2 41-49(K41F,A42V,Y48F) | FVSEKIFFV | 165 | 22/8421 | 8.8 | 1.7 | 20 | 10 | |
| SSX2 41-49(K41F,A42V,Y48S) | FVSEKIFSV | 166 | 24/1531 | 3.8 | 3.9 | 20 | >10 | |
| SSX2 41-49(K41F,A42V,Y48(Phe-4F)) | FVSEKIF(Phe-4F)V | 167 | N/A | 10.6 | 1.4 | 24 | 10 | |
| SSX2 41-49(K41F,A42V,Y48Phg) | FVSEKIF(Phg)V | 168 | N/A | 5.85 | 2.5 | >24 | >10 | |
| SSX2 41-49(K41F,A42V,46L,Y48T) | FVSEKLFTV | 169 | 24/1531 | 5.67 | 2.6 | 24 | >10 | |
| SSX2 41-49(K41F,A42V,46L,Y48S) | FVSEKLFSV | 170 | 24/1531 | N/A | N/A | N/A | N/T | |
| N-端一级/二级锚点,C-端一级锚点,TCR位点 | SSX2 41-49(K41F,A42V,I46L,Y48T,V49A) | FVSEKLFTA | 171 | 18/109 | 6.3 | 2.3 | 12 | >10 |
| SSX2 41-49(K41F,A42V,I46L,Y48S,V49A) | FVSEKLFSA | 172 | 18/109 | 6.2 | 2.4 | N/A | >10 |
6.C端酰胺
在一些实施方案中,可以修饰C端残基,以含有取代游离的羧酸的酰胺。因此,例如,如果所述肽是9-mer(九聚体),那么可以修饰P9残基。如果所述肽是10-mer(十聚体),那么可以修饰P10残基。优选地,这形成在生物介质中具有增加的稳定性的肽或类似物,所述生物介质包括但不限于血、淋巴、和CNS。优选地,所述肽可以保留其它必要的活性,以形成可用于接种疫苗或作为免疫原的类似物。表6是C-端酰胺修饰和每一修饰的结果的总结。
表6
C端酰胺
| 种类 | 肽名 | 序列 | SEQIDNO. | 预测得分(R/NIH) | 半最大结合(□M) | 相对亲和力(1/RA) | 稳定性(T1/2)(小时) | 交叉反应性和fct亲和力(类似物固有)* |
| 天然的 | SSX2 41-49 | KASEKIFYV | 1 | 22/1017 | 14.64 | 1.0 | 11 | 1 |
| N-端一级锚点 | SSX2 41-49-NH2 | KASEKIFYV-NH2 | 173 | N/A | N/B | N/B | N/T | >10 |
| SSX2 41-49-NH2(A42L) | KLSEKIFYV-NH2 | 174 | N/A | N/B | N/B | N/T | 3 | |
| SSX2 41-49-NH2(A42V) | KVSEKIFYV-NH2 | 175 | N/A | N/B | N/B | N/T | 10 |
7.十聚体
典型的MHC结合肽的长度可以从大约8个到大约11个氨基酸的长度而不等。然而,大多数早先应用的HLA-A*0201是9-mers(九聚体)或10-mers(十聚体)。因此,在一个实施方案中,所述类似物可以是野生型序列SSX-241-50的类似物。然而,由于所述野生型10-mer没有正确的结合基序并且没有表现出免疫学活性,所以通过取代在P10位置的氨基酸而制备10-mer,并且鉴定各种野生型和类似物的作用(参见图1B)。
8.其余残基
参考图1A和1B,任何残基还可以用保守氨基酸取代。保守取代可以与任何上述可以产生作用的取代组合。备选地,保守取代可以特异性地在这样的残基,即,据信其不参与一级、二级、或者甚至三级水平的任何活性。这样的残基包括P3、P5和P7。例如,在位置P3的丝氨酸可以用丙氨酸或苏氨酸取代而产生类似物。典型地,这样的保守取代没有显著地影响类似物的活性,然而,在一些实施方案中,它们可以增加某些活性或减少某些活性。
NY-ESO-1
157-165
类似物
上文公开了许多关于各种实施方案的特征和类似物设计的方面,通用的或如应用到SSX-2表位上。应该理解这样的公开也可以应用到这一表位和后续的表位上。为了简洁,将这样的公开的明确重述减少到最少。
实施方案涉及I类MHC限制性T细胞表位NY-ESO-1157-165,SLLMWITQC(SEQ ID NO.25)的类似物,包括这些可以被pAPC处理而呈递所述表位类似物的类似物的多肽,和表达所述类似物的核酸。与野生型表位相比较,所述类似物可以具有相似的或提高的免疫学特性。
一个实施方案涉及衍生并且改善NY-ESO-1157-165的类似物的方法,以及包括取代的特异序列。所述类似物可以含有至少一种取代,但是可以具有多种取代,包括单一的或以各种组合的标准的或非标准的氨基酸。所述类似物可以形成具有保留的或改善的特性的肽。
通过测定针对这样的细胞的表位特异性T细胞活性,已经表明表位NY-ESO-1157-165由NY-ESO-1表达细胞系呈递(Jaeger,E.等.,J.Exp.Med.(实验医学杂志)187:265-270,1998;美国专利号6,274,145,题目为“ISOLATED NUCLEIC ACID MOLECULE ENCODING CANCERASSOCIATED ANTIGEN,THE ANTIGEN ITSELF,AND USESTHEREOF”(“编码癌症相关抗原的分离的核酸分子,抗原本身,及其应用”)),其每一个通过参考完全并入本申请中。在题目为“NY-ESO-1-PEPTIDE DERIVATIVES,AND USES THEREOF(NY-ESO-1-肽衍生物及其应用)”的美国专利号6,417,165中描述了改善肽NY-ESO-1157-165的物理化学特性的方法,其通过参考完全并入本申请中,并且所述方法可以由用保持或增强与MHC的相互作用且没有干扰活性的二硫C-C键形成的不利特性的其它氨基酸置换末端半胱氨酸而组成。然而,C端半胱氨酸残基的单独处理忽视了这样的益处,即,优化遍及用于主要组织相容性(MHC)和/或T细胞受体(TCR)结合的肽的多个残基。因此,除了突变Cys残基的实用性外,存在相当多突变遍及所述肽的其它氨基酸的机会。例如,取代可以用于以使得在临床中更加有效的方式进一步优化与MHC和/或TCR的结合。
实施方案涉及长度为9或10个氨基酸的一种或多种肽的家族,其在序列上与人睾丸癌(CT)抗原NY-ESO-1的氨基酸157-165(NY-ESO-1157-165)相关。
类似物设计
所述类似物通常是NY-ESO-1157-165的类似物,其具有序列SLLMWITQC(SEQ ID NO:25)。野生型氨基酸是优选的还是非优选的分析应用早先关于其它肽-MHC或TCR相互作用的分析。例如,由于它没有产生同HLA分子的强相互作用,所以在C端的半胱氨酸通常是非优选的锚定残基,并且因此,取代这一残基是高度优选的。然而,尽管在位置P1的丝氨酸通常是优选的,但是发现取代芳族氨基酸可产生具有改善的特性的肽。并且,在位置P2的亮氨酸通常是可接受的,但是取代疏水性和/或大氨基酸导致具有改善的活性的肽。主要参与同TCR相互作用的残基(P4、P6和P8)表现出通常对于某种极性的偏好,并且在P8的情形中,芳族氨基酸(aromatic)通常产生具有有利特性的肽。
一个优选的实施方案涉及在P2位置具有取代的类似物。在一个这样的实施方案中,所述取代可以是疏水性残基。在另一个实施方案中,所述取代可以是大的疏水性残基。在另一个实施方案中,P1的残基可以用更加疏水的残基取代。在另一个实施方案中,残基P1和P2都可以用更加疏水的残基取代。在其它实施方案中,在P1、P2、和P9的至少一个残基可以被取代。在另一个实施方案中,在P1、P2、和P9的至少两个残基可以被取代。在另一个实施方案中,在P1、P2、P9、P4和P6的至少两个残基可以被取代,包括参与TCR结合的一个或多个残基。在另一个实施方案中,在P8的残基可以用芳香残基取代。下述取代的实例在图13A-13C中显示。
1.N端近端一级锚点修饰(P2)
N端一级锚点是肽的第二个N端氨基酸,因此,它是N端近端的一级锚点。尽管对于与MHC分子结合,初始亮氨酸158不被认为是“非优选的”,但是取代可以产生具有提高的结合的肽。因此,在一个实施方案中,野生型序列中的初始Leu 158可以用相似的或更加疏水性的氨基酸取代。可以应用任何疏水性的氨基酸,包括任何可用的或为本领域的技术人员已知的,包括标准氨基酸和非标准氨基酸。在另一个实施方案中,初始Leu 158可以用还具有大侧链的更加疏水的氨基酸取代。更加疏水性的氨基酸的实例包括,但不限于:Leu、Val、Ile、Met、α-氨基丁酸、正亮氨酸和正缬氨酸。并且,萘亚甲基侧链也可被取代。优选地,所述取代导致与HLA分子的提高的结合和稳定性。然而,这一残基可以二级或三级参与TCR相互作用,并且取代还可以导致提高的被TCR的识别。
2.N端二级锚点修饰(P1)
N端二级锚点是在N端的第一个氨基酸或P1。这一残基参与许多相互作用。残基Ser 157被确定为与HLA-A*0201分子相互作用的二级锚点残基,它还在某种程度上参与与T细胞受体的相互作用。因此,这一位置的修饰产生一些更有免疫原性并且更适于研发肿瘤疫苗的不规则的类似物。因此,取代可以导致许多改善的性质。
尽管丝氨酸没有被认为是“非优选的”,但是许多取代可以导致改善的肽的性质。因此,在一个实施方案中,在野生型序列中的初始Ser 157可以用更加疏水的氨基酸取代。可以应用任何更加疏水的氨基酸,包括可用的或本领域的技术人员已知的,包括标准氨基酸和非标准氨基酸。更加疏水的氨基酸的实例包括,但不限于:Phe、Tyr、Trp、和D-Lys。
3.N端一级和二级修饰(P2和P1)
在一个实施方案中,一级和二级锚定残基都被取代,而导致对HLA分子提高的结合亲和力。在另一个实施方案中,所述双取代产生与HLA分子结合的提高的稳定性。其它实施方案中,结合和/或稳定性没有提高,并且甚至可以被减小,但是改善了所述分子的其它特性,诸如活性或被耐受个体的识别。
4.N端一级/二级锚点和C端一级修饰(P2,P1和P9)
野生型肽的C端半胱氨酸通常是非优选的锚定残基。由于这一残基通常主要参与同MHC分子的相互作用,所以可以优选地取代导致与MHC分子更强的相互作用的残基。因此,取代表现出提高的结合亲和力和稳定性,并且在一些情形中,导致具有减少交叉反应性的类似物。在一些实施方案中,对C端的取代可以形成具有提高的结合和/或稳定性而没有减少的交叉反应性的肽。然而,在其它实施方案中,对C端的取代可以形成具有提高的结合和/或稳定性具有相等的或减少的交叉反应性的肽。由于先前已经表明这一残基的取代提供改善的肽,所以可以优选地产生这样的肽,即,其在与MHC分子的相互作用以及其它相互作用中,诸如被TCR识别中,是更加改善的。因此,在一些实施方案中,C端的取代可以与至少一种其它取代组合(paired)。对C端氨基酸的取代的实例包括,但不限于,缬氨酸、赖氨酸、丙氨酸、和异亮氨酸。
5.N端一级/二级锚点和TCR残基修饰
参与同TCR相互作用的主要残基通常被认为是残基P4、P6、和P8。然而,其它残基也可以较少程度地参与所述相互作用。在一个实施方案中,可以取代主要参与TCR相互作用的一个或多个位点以导致改善的相互作用。优选地,这些取代产生不规则的类似物,所述类似物不妨碍与MHC分子结合,但是克服野生型肽的耐受问题。在一个实施方案中,可以包括至少一种TCR取代,在位置P1、P2、和/或P9具有至少一个取代。在一个实施方案中,在P4、P6、和P8,具有某种极性的氨基酸可以取代。在另一个实施方案中,芳族氨基酸可以在P8位置被取代。
6.C端酰胺
在一些实施方案中,可以修饰C端残基,以含有取代游离的羧酸的酰胺。因此,例如,如果所述肽是9-mer(九聚体),那么可以修饰P9残基。如果所述肽是10-mer(十聚体),那么可以修饰P10残基。优选地,这形成在生物介质中具有增加的稳定性的肽或类似物,所述生物介质包括但不限于血、淋巴、和CNS。优选地,所述肽保留它们其它的活性,以形成可用于接种疫苗或作为免疫原的类似物。
7.十聚体
典型的MHC结合肽的长度从大约8个到大约11个氨基酸的长度而不等。然而,大多数早先应用的HLA-A*0201是9-mers(九聚体)或10-mers(十聚体)。因此,在一个实施方案中,所述类似物可以是野生型序列NY-ESO-1157-166的10-mer。然而,由于所述野生型10-mer没有正确的结合基序并且没有表现出免疫学活性,所以通过取代在P10位置的氨基酸而制备10-mer,并且鉴定各种修饰的作用(参见图13A-13C)。在一个实施方案中,在C端添加或取代野生型的残基可以选自由正缬氨酸、亮氨酸、异亮氨酸、缬氨酸、和丙氨酸组成的组。
8.其余残基
参考图13A和13C,任何残基还可以用保守氨基酸取代。保守取代可以与可以产生作用的上述任何取代组合。备选地,保守取代可以特异性地在这样的残基,即,据信其不参与一级、二级、或者甚至三级水平的任何活性。这样的残基可以包括P3、P5和/或P7。保守取代是本领域的技术人员已知的,但是,例如,在位置P3的亮氨酸可以用丙氨酸或苏氨酸取代而产生类似物。典型地,这样的保守取代没有显著地影响类似物的活性。然而,在一些实施方案中,它们可以增加某些活性或减少某些活性。由于已知的相互作用,这样的保守取代不可能对任何活性都具有显著的作用。
PSMA
288-297
类似物
上文公开了许多关于各种实施方案的特征和类似物设计的方面,通用的或如应用到具体表位上。应该理解这样的公开内容也可以应用到这一表位和后续的表位上。为了简洁,将这样的公开的清楚重述减少到最少。
一些实施方案涉及I类MHC限制性T细胞表位PSMA288-297,GLPSIPVHPI(SEQ ID NO.42)的类似物,包括这些可以被pAPC处理而呈递所述表位类似物的类似物的多肽,和表达所述类似物的核酸。与野生型表位相比较,所述类似物可以具有相似的或提高的免疫学特性。确认这一表位通过人癌症细胞呈递的证据在下述实施例32中描述。
一个实施方案涉及衍生和改善PSMA288-297的类似物的方法,以及包括取代的特异序列。所述类似物可以含有至少一种取代,但是可以具有多种取代,包括单一的或以各种组合的标准的或非标准的氨基酸。所述类似物可以形成具有保留的或改善的特性的肽。
实施方案涉及长度为9或10个氨基酸的一种或多种肽的家族,其在序列上与人PSMA的氨基酸288-297相关。
类似物设计
在一些实施方案中,PSMA288-297类似物可以含有序列GLPSIPVHPI(SEQ ID NO.42)的取代。参考结合基序数据,诸如在下述实施例2中的表7所列出的那些,表明P2锚定残基可以在A2.1-限制性表位中对任何位置的亲和力做出最大的个体贡献。在这种情形中,在P2位置的氨基酸是最理想的优选的亮氨酸。PΩ锚定残基,异亮氨酸,是有利的。应用T2细胞检测系统的体外结合研究(未显示)已经表明,特别是当与SSX-2和NY-ESO-1表位相比较时,天然肽通常具有优良的结合特征。尽管这与饱和度的相对少的上升相匹配,但是所述表位在相对低的浓度表现出显著的结合。可以改善野生型表位。诸如表7和8所代表的那些分析是平均情况,并且在具体序列中给出的残基的行为可能不同于平均情况。与对于上文讨论的SSX-2和NY-ESO-1表位用Nle和Nva所获得的有利结果相一致,Nle和Nva还可以成功地用于所述PSMA表位。最后,如果与帮助克服可能存在的针对所述表位的任何耐受性的变化相组合,即使相似的结合特征可以增加所述肽的有效免疫原性。在转基因小鼠模型中,天然肽很少有免疫原性(例如参见实施例35),其可以反映针对所述表位的耐受性;在小鼠和人PSMA之间,这一表位由此所衍生的PSMA区域是相同的。
1.N端近端一级锚点修饰(P2)
如上文所述,尽管在这一表位P2位置的天然残基通常是遗传编码的氨基酸中优化的残基,但是,对于结合、耐受性破坏和交叉反应免疫性的潜在的改善,检验了取代其它优选的或大的疏水性残基的效果。示例性的取代可以包括Met、Ile、Gln、Val、Nva、Nle、和氨基丁酸(Abu)。
2.N端二级锚点修饰(P1)
N端二级锚点是N端的第一个氨基酸。天然Gly是在这一位置唯一边缘性优选的。各种观察(例如参见表7和8)表明具有改善所述表位的潜力的氨基酸包括Ala、Ser、Abu和肌氨酸(sarkosine)(Sar,即,N-甲基甘氨酸)。
3.C端一级锚点修饰(PΩ)
在这一位置的天然Ile通常是优选的但不是最理想的残基。在这一位置的取代可以改善结合。示例性的取代可以包括Val、Leu、Nva、和Nle。
4.二级锚点和TCR研究
倒数第二个位置(PΩ-1)可以作为二级锚点和TCR相互作用的位置。尽管它还可以促进改善的结合,但是Ala、Leu、Ser、或Thr的取代可以具有对TCR相互作用的主要作用。P3是可以影响结合和免疫原性的另一个位置。在这一位置的Trp取代可以改善二者。
为了组合、协同、并且抵消用单一取代获得的各种效果,其它实施方案涉及在多个位置的取代的组合。
PRAME
424-433
类似物
上文公开了许多关于各种实施方案的特征和类似物设计的方面,通用的或应用到具体表位上。应该理解这样的公开内容也可以应用到这一表位和后续的表位上。为了简洁,将这样的公开的清楚重述减少到最少。
实施方案包括I类MHC-限制性T细胞表位PRAME425-433,SLLQHLIGL(SEQ ID NO.71)的类似物,包含这些可以被pAPC处理而呈递所述表位类似物的类似物的多肽,和表达所述类似物的核酸。与野生型表位相比较,所述类似物可以具有相似的或提高的免疫学特性。确认这一表位通过人癌症细胞呈递的证据在下述实施例39中描述。
一个实施方案涉及衍生并且改善PRAME425-433的类似物的方法,以及包括取代的特异序列。所述类似物可以含有至少一种取代,但是可以具有多种取代,包括单一的或以各种组合的标准的或非标准的氨基酸。所述类似物可以形成具有保留的或改善的特性的肽。
一些实施方案涉及长度为9或10个氨基酸的一种或多种肽的家族,其在序列上与人PRAME序列的氨基酸425-433相关。
类似物设计
一些实施方案涉及PRAME425-433的类似物,其可以含有序列SLLQHLIGL(SEQ ID NO.71)的取代。参考结合基序数据,诸如在下述实施例2表7中列出的那些,表明P2锚定残基可以在A2.1-限制性表位中对任何位置的亲和力做出最大的个体贡献。在这种情形中,在P2位置的氨基酸是最理想优选的亮氨酸。PΩ锚定残基,亮氨酸是有利的,尽管不是强优选的,对于所述位置野生型PΩ残基也不必是最优选的。诸如表7和8所报道的那些分析是平均情况,并且具体序列中给出的残基的行为可能不同于平均情况。与对于其它表位用Nle和Nva所获得的有利结果相一致,用Nle和Nva取代这一序列可以获得相似的改善。最后,如果与帮助克服可能存在的针对所述表位的任何耐受性的变化相配合,即使相似的结合特征也可以增加所述肽的有效免疫原性。
各种取代的基本原理已经在上文中列出。对于PRAME425-433表位所研究的具体取代遵循相同的逻辑,并且在实施例40-48和图25-27中公开。取代在一级锚定位置P2和PΩ(P9)、二级锚定位置P1和PΩ-1(P8)进行。取代还可以在TCR相互作用位置(除了二级锚定位置外)P3和P6进行。所选的取代对I类MHC-肽复合体的结合和/或稳定性有影响;I类MHC-肽复合体的结合和/或稳定性是确定肽的免疫学特性的关键特征。另外,由于T细胞总体考虑,并且为了克服负责针对天然表位的有限的免疫性的机制,保持类似物与识别天然肽的T细胞受体相互作用的能力的取代可以是有实用价值的。
实施例
下述实施例提供类似物和鉴定类似物的方法。所述类似物可以用作,例如,免疫原,疫苗,和/或各种癌症的治疗。所述类似物可以如在实施例1中那样制备。SSX-241-49类似物如在实施例2中所示那样确定,并且在实施例3中列出。如实施例4-21所示那样检测所述类似物改善的特性。检测NY-ESO-1157-165类似物的改善的特性在实施例22-30中描述。检测PSMA类似物的改善的特性在实施例33-38中描述。检测PRAME425-433类似物的改善的特性在实施例40-48中描述。
实施例1
肽合成、纯化和特征鉴定
应用标准的Fmoc固相化学,在Symphony多种肽合成仪(PTI技术公司(PTI technologies),马萨诸塞州(MA))或ABI 433A肽合成仪(应用生物系统(Applied Biosystems),福斯特城,加利福尼亚州)上以0.05-0.1毫摩尔规模合成肽。应用预装的PEG-PS树脂(在Symphony上)或Wang树脂(在ABI上)合成C端游离酸肽。C端酰胺化的肽在Fmoc-PAL-PEG-PS树脂上合成。所有的树脂从应用生物系统(Applied Biosystems)(福斯特城,加利福尼亚州)购买。在肽合成中应用的Fmoc-氨基酸从诺瓦生物化学(Novabiochem)(圣地亚哥,加利福尼亚州)和AnaSpec(圣何塞,加利福尼亚州)购买。通过标准流程进行合成后的切割。
肽的纯化在半制备HPLC柱或SPE柱体(菲罗门(Phenomenex),托兰斯,加利福尼亚州)上进行。所有肽的纯度≥90%。通过Maldi-TOF MS(Voyager DE,应用生物系统(Applied Biosystems))和应用Synergi C12柱(菲罗门(Phenomenex),托兰斯,加利福尼亚州)的分析HPLCs(瓦里安(Varian)或岛津(Shimazu)),检验每种肽的特性。
实施例2
从新设计的SSX-2
41-49
类似物
中等抗原性肽的结构修饰可以极大地改善肽-MHC结合、CTL识别、和/或免疫原性。关于怎样修饰野生型表位以获得具有增强的功效的肽类似物的综合指导是本领域已知的。一个重要的策略是将讨论中用于结合具体的MHC分子的所谓的锚定位置的残基优化。在HLA-A2的情形中,已经观察到在P2和PΩ位置对疏水性残基的显著偏爱,特别是在P2的L和M,以及在PΩ的V(PΩ表示表位的C端残基。对于HLA-A2,取决于所述肽的长度,其是P9或P10。)。用芳香残基,诸如F、Y和W置换P1位置也可以是有利的。
表7.BIMAS运算法则所用的系数
(运算法则可以通过超文本转移链接:
//bimas.cit.nih.gov/molbio/hla_bind/可用)
表8.通过SYFPEITHI运算法则所用的HLA-A*0201的得分模式(9-mers)
(运算法则可以通过超文本转移链接:
//syfpeithi.bmi-heidelberg.com/scripts/MHCServer.dll/home.htm可用)
| AA | P1 | P2 | P3 | P4 | P5 | P6 | P7 | P8 | P9 |
| A | 2 | 6 | 2 | 0 | 0 | 0 | 2 | 1 | 6 |
| C | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| D | -1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 |
| E | -1 | 0 | -1 | 2 | 0 | 0 | 0 | 2 | 0 |
| F | 1 | 0 | 1 | -1 | 1 | 0 | 0 | 0 | 0 |
| G | 1 | 0 | 0 | 2 | 2 | 0 | 0 | 1 | 0 |
| H | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| I | 2 | 8 | 2 | 0 | 0 | 6 | 0 | 0 | 8 |
| K | 1 | 0 | -1 | 0 | 1 | 0 | -1 | 2 | 0 |
| L | 2 | 10 | 2 | 0 | 1 | 6 | 1 | 0 | 10 |
| M | 0 | 8 | 1 | 0 | 0 | 0 | 0 | 0 | 6 |
| N | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 |
| P | 0 | 0 | 0 | 2 | 1 | 0 | 1 | 0 | 0 |
| Q | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| R | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| S | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 2 | 0 |
| T | 0 | 6 | -1 | 0 | 0 | 2 | 0 | 2 | 6 |
| V | 1 | 6 | 0 | 0 | 0 | 6 | 2 | 0 | 10 |
| W | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 |
| X | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Y | 2 | 0 | 1 | -1 | 1 | 0 | 1 | 0 | 0 |
摘自:Rammensee,Bachmann,Stevanovic:MHC ligands and peptide motifs(MHC配体和肽基序).Landes Bioscience(Landes生物科学)1997
实施例3
下述类似物应用实施例1中的预测而产生。
表9.
| 种类 | SEQ ID号 | 肽名 | 序列 |
| 野生型 | 1 | SSX-2 41-49 | KASEKIFYV |
| N-端一级锚点 | 102 | SSX-2 41-49(A42L) | KLSEKIFYV |
| 103 | SSX-2 41-49(A42V) | KVSEKIFYV | |
| 104 | SSX-2 41-49(A42I) | KISEKIFYV | |
| 105 | SSX-2 41-49(A42M) | KMSEKIFYV | |
| 106 | SSX-2 41-49(A42(D-Ala)) | K(D-Ala)SEKIFYV | |
| 107 | SSX-2 41-49(A42(D-Leu)) | K(D-Leu)SEKIFYV | |
| 108 | SSX-2 41-49(A42(D-Val)) | K(D-Val)SEKIFYV | |
| 109 | SSX-2 41-49(A42(Nal-1)) | KNal-1SEKIFYV | |
| 110 | SSX-2 41-49(A42(Nal-2)) | KNal-2SEKIFYV | |
| 111 | SSX-2 41-49(A42(Abu)) | KAbuSEKIFYV | |
| 112 | SSX-2 41-49(A42(Nle)) | KNleSEKIFYV | |
| 113 | SSX-2 41-49(A42(Nva)) | KNvaSEKIFYV | |
| 114 | SSX-2 41-49(A42(Aib)) | KAibSEKIFYV |
| N-端二级锚点 | 115 | SSX-2 41-49(K41F) | FASEKIFYV |
| 116 | SSX-2 41-49(K41W) | WASEKIFYV | |
| 117 | SSX-2 41-49(K41Y) | YASEKIFYV | |
| 118 | SSX-2 41-49(K41(D-Lys)) | (D-Lys)ASEKIFYV | |
| 119 | SSX-2 41-49(K41(Phg)) | PhgASEKIFYV | |
| 120 | SSX-2 41-49(K41(Cha)) | ChaASEKIFYV | |
| 121 | SSX-2 41-49(K41(Phe-4F)) | Phe(4-F)ASEKIFYV | |
| 122 | SSX-2 41-49(K41(Phe-4NO2)) | Phe(4-NO2)ASEKIFYV | |
| 123 | SSX-2 41-49(K41(O-甲基Tyr)) | O-甲基-TyrASEKIFYV | |
| 124 | SSX-2 41-49(K41(β-(3-苯并噻吩基)Ala)) | β-(3-苯并噻吩基)AlaASEKIFYV | |
| N-端一级/二级锚点 | 125 | SSX-2 41-49(K41Y,A42L) | YLSEKIFYV |
| 126 | SSX-2 41-49(K41Y,A42V) | YVSEKIFYV | |
| 127 | SSX-2 41-49(K41Y,A42M) | YMSEKIFYV | |
| 128 | SSX-2 41-49(K41Y,A42I) | YISEKIFYV | |
| 129 | SSX-2 41-49(K41F,A42L) | FLSEKIFYV | |
| 130 | SSX-2 41-49(K41F,A42V) | FVSEKIFYV | |
| 131 | SSX-2 41-49(K41F,A42M) | FMSEKIFYV | |
| 132 | SSX-2 41-49(K41F,A42I) | FISEKIFYV | |
| 133 | SSX-2 41-49(K41W,A42L) | WLSEKIFYV | |
| 134 | SSX-2 41-49(K41W,A42V) | WVSEKIFYV | |
| 135 | SSX-2 41-49(K41W,A42M) | WMSEKIFYV | |
| 136 | SSX-2 41-49(K41W,A42I) | WISEKIFYV | |
| 137 | SSX-2 41-49(K41(D-Lys),A42L) | (D-Lys)LSEKIFYV | |
| 138 | SSX-2 41-49(K41(D-Lys),A42V) | (D-Lys)VSEKIFYV | |
| N-端一级/二级锚点,C-端一级锚点 | 139 | SSX-2 41-49(K41F,A42V,V49L) | FVSEKIFYL |
| 140 | SSX-2 41-49(K41F,A42V,V49I) | FVSEKIFYI | |
| 141 | SSX-2 41-49(K41F,A42V,V49A) | FVSEKIFYA | |
| 142 | SSX-2 41-49(K41F,A42V,V49M) | FVSEKIFYM | |
| 143 | SSX-2 41-49(K41F,A42V,V49Nle) | FVSEKIFY(Nle) | |
| 144 | SSX-2 41-49(K4IF,A42V,V49Nva) | FVSEKIFY(Nva) | |
| 145 | SSX-2 41-49(K41F,A42V,V49MeVal) | FVSEKIFY(MeVal) | |
| 176 | SSX-2 41-49(K41F,A42V,V49MeLeu) | FVSEKIFY(MeLeu) | |
| 146 | SSX-2 41-49(K41F,A42V,V49Aib) | FVSEKIFY(Aib) | |
| 147 | SSX-2 41-49(K41F,A42V,V49Abu) | FVSEKIFY(Abu) | |
| N-端一级/二级锚点,TCR位点 | 152 | SSX-2 41-49(K41F,A42V,E44D) | FVSDKIFYV |
| 153 | SSX-2 41-49(K41F,A42V,E44N) | FVSNKIFYV | |
| 154 | SSX-2 41-49(K41F,A42V,E44S) | FVSSKIFYV | |
| 155 | SSX-2 41-49(K41F,A42V,E44T) | FVSTKIFYV | |
| 156 | SSX-2 41-49(K41F,A42V,E44Q) | FVSQKIFYV | |
| 157 | SSX-2 41-49(K41F,A42V,E44(Nle)) | FVS(Nle)KIFYV | |
| 158 | SSX-2 41-49(K41F,A42V,E44(Nva)) | FVS(Nva)KIFYV | |
| 159 | SSX-2 41-49(K41F,A42V,I46L) | FVSEKLFYV | |
| 160 | SSX-2 41-49(K41F,A42V,I46V) | FVSEKVFYV |
| 161 | SSX-2 41-49(K41F,A42V,I46M) | FVSEKMFYV | |
| 162 | SSX-2 41-49(K41F,A42V,I46(Nle)) | FVSEK(Nle)FYV | |
| 163 | SSX-2 41-49(K41F,A42V,I46(NVa)) | FVSEK(Nva)FYV | |
| 164 | SSX-2 41-49(K41F,A42V,Y48T) | FVSEKIFTV | |
| 165 | SSX-2 41-49(K41F,A42V,Y48F) | FVSEKIFFV | |
| 166 | SSX-2 41-49(K41F,A42V,Y48S) | FVSEKIFSV | |
| 167 | SSX-2 41-49(K41F,A42V,Y48(Phe-4F)) | FVSEKIF(Phe4-F)V | |
| 168 | SSX-2 41-49(K41F,A42V,Y48(Phg)) | FVSEKIF(Phg)V | |
| 169 | SSX-2 41-49(K41F,A42V,I46L,Y48T) | FVSEKLFTV | |
| 170 | SSX-2 41-49(K41F,A42V,I46L,Y48S) | FVSEKLFSV | |
| N-端一级/二级锚点,C-端一级锚点,TCR位点 | 171 | SSX-2 41-49(K41F,A42V,I46L,Y48T,V49A) | FVSEKLFTA |
| 172 | SSX-2 41-49(K41F,A42V,I46L,Y48S,V49A) | FVSEKLFSA | |
| N-端一级锚点,C-端一级锚点 | 148 | SSX-2 41-49(A42V,V49I) | KVSEKIFYI |
| 149 | SSX-2 41-49(A42L,V49I) | KLSEKIFYI | |
| 150 | SSX-2 41-49(A42(D-Ala),V49(D-Val)) | K(D-Ala)SEKIFY(D-Val) | |
| SSX-2 41-49(A42(D-Leu),V49(D-Val)) | K(D-Leu)SEKIFY(D-Val) | ||
| SSX-2 41-49(A42(D-Val),V49(D-Val)) | K(D-Val)SEKIFY(D-Val) | ||
| C-端一级锚点 | 151 | SSX-2 41-49(V49I) | KASEKIFYI |
| C-端酰胺 | 173 | SSX-2 41-49-NH2 | KASEKIFYV-NH2 |
| 174 | SSX-2 41-49-NH2(A42L) | KLSEKIFYV-NH2 | |
| 175 | SSX-2 41-49-NH2(A42V) | KVSEKIFYV-NH2 | |
| 十聚体 | 177 | SSX-2 41-50 | KASEKIFYVY |
| 178 | SSX-2 41-50(Y50I) | KASEKIFYVI | |
| 179 | SSX-2 41-50(Y50L) | KASEKIFYVL | |
| 180 | SSX-2 41-50(Y50V) | KASEKIFYVV | |
| 181 | SSX-2 41-50(Y50(Nle)) | KASEKIFYV(Nle) | |
| 182 | SSX-2 41-50(Y50(Nva)) | KASEKIFYV(Nva) | |
| 183 | SSX-2 41-50(A42V,Y50I) | KVSEKIFYVI | |
| 184 | SSX-2 41-50(A42L,Y50I) | KLSEKIFYVI | |
| 185 | SSX-2 41-50(A42V,Y50L) | KVSEKIFYVL | |
| 186 | SSX-2 41-50(A42L,Y50L) | KLSEKIFYVL | |
| 187 | SSX-2 41-50(A42V,Y50V) | KVSEKIFYVV | |
| 188 | SSX-2 41-50(A42L,Y50V) | KLSEKIFYVV | |
| 189 | SSX-2 41-50(A42V,Y50(Nle)) | KVSEKIFYV(Nle) | |
| 190 | SSX-2 41-50(A42L,Y50(Nle)) | KLSEKIFYV(Nle) | |
| 191 | SSX-2 41-50(A42V,Y50(Nva)) | KVSEKIFYV(Nva) | |
| 192 | SSX-2 41-50(A42L,Y50(Nva)) | KLSEKIFYV(Nva) | |
| 193 | SSX-2 41-50(A42V,V49I,Y50I) | KVSEKIFYII | |
| 194 | SSX-2 41-50(A42L,V49I,Y50I) | KLSEKIFYII | |
| 195 | SSX-2 41-50(V49I,Y50I) | KASEKIFYII |
用于非标准氨基酸的缩写如下:Nle,正亮氨酸;Nva,正缬氨酸;Phg,苯基甘氨酸;Phe(4-F),4-氟苯丙氨酸;Phe(4-NO2),4-硝基苯丙氨酸;Abu,α-氨基丁酸;Aib,α-氨基异丁酸;MeLeu,甲基-亮氨酸;MeVal,甲基缬氨酸;β-(3-苯并噻吩基)Ala,β-(3-苯并噻吩基)-丙氨酸;O-甲基-Tyr,O-甲基酪氨酸;Cha,环己基丙氨酸;Nal-l,β-(1-萘基(napthyl))-丙氨酸;Nal-2,β-(2-萘基)-丙氨酸;-NH2表示羧基端已经被修饰成为酰胺。
实施例4-21
检测SSX-2
41-49
类似物
在下述实施例4-21中检测实施例3中产生的类似物的活性,诸如结合和生物效果:
实施例4
应用T2细胞的肽的结合
应用基于T2细胞的检测,评估肽类似物和野生型表位与HLA-A*0201的亲和力(Regner M,等.,Exp Clin Immunogenet.(实验临床免疫遗传学)1996;13(1):30-5;其通过参考完全并入本申请中)。
对于结合检测,简要地说,将缺少TAP的表达并且因此不在细胞表面装配稳定的I类MHC的T2细胞用不同浓度的肽(对照或类似物)在37℃脉冲处理(pulsed)过夜,充分洗涤,用识别I类MHC(A2等位基因)的荧光标记抗体染色,并且通过FacsScan分析仪运行。在与给定浓度的类似物和阴性对照(非MHC结合物)相对应的MFI(平均荧光强度)之间的差异,是有多少MHC和肽之间的稳定复合体在T2细胞表面展示的函数。因此,在肽的有限浓度,这主要是Kon的测量,并且在肽的饱和水平,是Kon和Koff的测量。所述结合通过两种数学相关的因子而量化:半最大结合(给出50%的与饱和相对应的信号的肽的浓度)和相对亲和力(1/RA)。相对亲和力RA是针对参考(野生型肽)标准化的结合;例如,在对照相对于肽类似物的半最大结合之间的比例。1/RA指数越高,并且半最大结合越低,类似物和MHC之间相互作用的Kon越高。
应用这些结合参数鉴定的53种类似物确定相对于野生型肽被改善。这些改善的结合物携带包括已知参与同MHC和/或TCR相互作用的位置的1个、2个、3个或多个取代(包括标准的和/或非标准的氨基酸)。然而,对MHC结合的全部作用取决于所述修饰。这样的肽类似物可以用于治疗性组合物或作为进一步衍生治疗性组合物的平台。
实施例5
应用T2细胞的肽的稳定性
关于MHC的肽稳定性(Koff)通常不能仅从结合(Kon)推断出来。由于T细胞的激活取决于“信号1”(MHC肽复合体与T细胞受体的相互作用)的持续时间,所以,关于这样的肽的免疫性特性,除了结合之外,肽在I类MHC上的稳定性公知是重要的。对于稳定性检测,简要地说,将缺少TAP的表达并且因此不在细胞表面装配稳定的I类MHC的T2细胞,用一定浓度的已知获得最大负荷的I类MHC(“饱和”)的肽(对照或类似物)在37℃脉冲处理过夜,充分洗涤,并且在吐根碱的存在下追踪(chased)不同的时间间隔,所述吐根碱阻滞内源蛋白的合成。充分洗涤后,将细胞用识别I类MHC(A2等位基因)的荧光标记抗体染色,并且通过FacsScan分析仪运行。在与给定浓度的类似物和阴性对照(非MHC结合物)相对应的MFI(平均荧光强度)之间的差异,是有多少MHC和肽之间的稳定复合体在T2细胞表面展示的函数。将所述信号随时间的衰减用数学法表示为相对于在0小时(在追踪时间间隔的开始)的结合的稳定指数的50%。
这样改善的类似物可以携带包括已知参与同MHC和/或TCR相互作用的位置的1个、2个、3个或多个取代(包括标准的和/或非标准的氨基酸),具有取决于所述修饰的对MHC稳定性的全部作用。这样的肽类似物可以用于治疗性组合物或作为进一步衍生治疗性组合物的平台。43种类似物相对于天然肽具有增加的稳定性。
表现出改善的结合和稳定性的类似物用于改善的组合物或者作为产生治疗益处的改善的组合物的平台。
实施例6
评估类似物的免疫学特性:
交叉反应性和功能亲和力
肽的免疫学特性可以描述为与MHC分子结合(Kon和Koff)和与TCR(TCR和MHC-肽复合体之间相互作用的亲和力)结合的函数。关于对与MHC分子结合的全部影响,一级MHC锚定残基的修饰通常具有显著程度的可预知性。
二级MHC锚定残基的修饰可以影响MHC-肽复合体与TCR的相互作用的亲和力以及相对于肽-MHC相互作用的Kon和Koff。
设计一种方法,其允许以与提议的应用方法一致的方式快速并且合理地筛选肽类似物,并且模拟全部免疫学特性(在整合方式中相对于MHC相互作用的Kon和Koff和TCR结合特性)。在一些实例中,这种方法包括产生针对天然(未突变的)表位(SSX-241-49)的T细胞系,和应用足以有效地在携带人MHC(诸如A2等位基因)的转基因小鼠中产生有效的应答的免疫策略。在活性APCs和所测定的对天然(未突变的)表位特异性的T细胞的功能性影响存在下,离体检验肽类似物。由于在交叉反应性肽的情形中期望的作用是两阶段性的(由于抗原-诱导的细胞死亡,AICD,在有限的浓度激活,并且在更高的浓度抑制),所述评估在类似物的不同浓度进行。下述3种参数的测定可以用来定义肽类似物的基本和有用的特征:
1.引发指示T细胞活化的作用(例如,细胞因子产生)的最小需要的肽类似物浓度;
2.在任何类似物浓度的最大(峰值)作用(例如,细胞因子产生);
3.在活化作用峰值的类似物浓度(例如,细胞因子浓度)。
例如,导致与参数#1和3相关的减少的值但是增加与参数#2相关的值的类似物,可以是有用的。将天然表位和不相关的非交叉反应性肽用作参考,在鉴定潜在值的类似物的种类中是有价值的。根据这样的事实,即,尽管它们保留交叉反应性,但是它们可以展现出与天然肽的免疫学特性截然不同的免疫学特性——例如,更低的在体内诱导AICD的倾向性或者破坏耐受性或恢复反应性的能力,仍然认为展现出数量上相当的或者甚至适当地从天然表位的特性适当减弱的特性的类似物是有用的。
这种筛选策略的一些优点包括实用性和快速性,应用更加相关的多克隆T细胞系而不是潜在有偏倚的T细胞克隆作为读出,和复合值,积分参数,诸如Kon、Koff和TCR亲和力,所述参数可以转化为肽-MHC复合体相对应TCR的交叉反应性和功能亲和力。这些参数可以预测体内免疫学特性,并且因此可以描述有用的肽类似物的全体,以进行进一步的评估、优化和实际应用。预计结合MHC并且保留针对对指定的野生型肽特异的TCR的交叉反应性的类似物在这一检测中引发可以测量的作用。全部方法在图2中描述。
用于产生T细胞系的方法如下:在第0,4,14和18天,将携带A2人等位基因的HHD转基因小鼠(Pascolo等.J.Exp Med.(实验医学杂志)185(12):2043-51,1997,其通过参考完全并入本申请中)用与25μg pIpC混合的50μg SSX-2天然表位(41-49)免疫,通过两侧施用到腹股沟淋巴结中而进行。在最后一次加强后7天,将小鼠处死,并且在完全HL-1培养基中制备5×106百万细胞/ml的脾细胞悬浮液。将细胞在平底96孔平板(200μl/孔)中与不同浓度的肽温育48小时,并且与添加到孔中的10U/ml的rIL-2继续温育24小时。收集上清,并且通过标准方法,诸如ELISA,评估IFN-γ的浓度
实施例7
在单一位置取代的类似物的交叉反应性和功能亲和力
将上述方法(实施例6,图2)用来检查相对于以其野生型形式的天然SSX-241-49表位(KASEKIFYV(SEQ ID NO.1))携带单一取代的类似物的文库(图3)。在离体激发IFN-γ产生的最少需要的类似物的量和在类似物的任何浓度产生细胞因子的最大量之间发现强的反相关性。
在这一检测中评估,用L、V或M取代A42改善了所述肽的免疫学特性。L和V突变体是有活性的。M比天然表位更具活性。I突变体保留了针对识别野生型表位的TCR的交叉反应性。
在位置42用非标准氨基酸Abu、Nle或Nva置换A改善了所述肽相对于野生型表位的免疫学特性,在引发细胞因子产生所需的类似物的最少量和所产生的细胞因子的最大量这两个方面改善。在这一检测中,相对于天然肽,包括D-Ala、D-Val、Nal-2或Aib的突变体表现出保留的交叉反应性和减少的免疫活性,但是还可以用于进一步的衍生(derivitization),以调整或增强它们的特性。在位置42的Nal-1消除了所述活性。
第一个残基K41的改变表明,尽管在这一检测中,用F或Phg置换提高了活性,但是W、D-Lys、和Cha消除了免疫学特性。用Y、Phe-4F、Phe(4-NO2)、O-甲基-Tyr或β-(3-苯并噻吩基-Ala)置换K保留了活性。
与初始表位相比较,通过用I置换位置V49(C端残基)的修饰以更低的水平保留了活性。通过添加-NH2部分而修饰最后的残基消除了肽的活性,所述活性随后通过在位置42用L或V修饰A而恢复。这直接表明,具有比野生型肽的活性更低的活性的类似物仍然可用于进一步的衍生。
实施例8
在两个位置取代的类似物的交叉反应性和功能亲和力
将实施例6的方法(图2)用来检查相对于以其野生型形式的野生型SSX-241-49表位携带两个取代的类似物的文库(图4)。
在位置1和2协调的修饰对类似物的活性具有可变的作用。例如,用Y、F或W取代K41,确证了(corroborated)用V、M或I取代A42,并导致类似物相对于野生型肽的保留的或增强的活性。由于P1残基在某种程度上参与结合TCR,所以,这样的双突变肽提供增加的机会,从而以导致耐受性破坏的方式影响同TCR的相互作用(因此对实际应用是有用的)。下列各项之间的组合:Y(位置41)与V(位置42),W(位置41)与I或L(位置42),和F(位置41)与L、V、I(位置42),形成相对于野生型肽更加有活性的类似物。在位置41的Y和位置42的I,或位置41的W和42的V或M之间的组合,赋予同野生型肽的活性相似的活性。在位置41用D-赖氨酸置换K,在这一检测中形成具有保留的活性的类似物。由于包括非标准氨基酸的这样肽的代谢降解在体内下降,这样的肽可以是非常有用的。
在位置42的V或L和位置49的I之间的组合导致比天然肽增加的活性。
实施例9
在多个位置取代的类似物的交叉反应性和功能亲和力
将实施例6的方法(图2)用来检查相对于以其野生型形式的天然SSX-241-49表位携带3个或更多取代的类似物的文库(图5)。
分别在位置41和42的F和V,与在位置49的I或A组合,导致相对于野生型表位改善的或相似的活性。相反,在位置49的L或M导致极大减少的活性。
在最后位置包括非标准氨基酸Nva、Abu或MeVal的三元突变体导致免疫活性的保持或提高。由于增加的体内稳定性和对酶促降解的抗性,这样的肽极其有用。
修饰在推定的TCR结合区域内的氨基酸残基可以形成相当大的价值的肽,其保持与MHC结合以及交叉反应性。由于它们在MHC槽中的构象与天然肽的构象稍微不同,所述肽用于恢复免疫应答性或者耐受性破坏。在位置44(Q,Nva或Nle)、位置46(L,V,Nle或Nva)或48(F或Phe-4F)的其它取代形成活性类似物,其中在位置44的D、N、S或T,在位置46的M或在位置48的T、S、Phg,或在位置46的L与在48的T,形成没有活性的类似物。最后,具有5个取代的2种类似物没有表现出活性(图5)。
实施例10
包括天然肽和在不同位置的突变的十聚体的交叉反应性和功能亲和力
将实施例6的方法(图2)用来检查包括指定的SSX-241-49肽的十聚体的类似物的文库(图6)。
十聚体SSX-241-50在刺激对41-49九聚体特异的T细胞系中,相对于后者显著地更不活跃。在位置50将Y残基修饰成I或L,但是以更少的或无的程度修饰成V、Nle或Nva,在这一检测中导致活性的恢复。十聚体类似物活性的进一步优化通过将位置2的A用L或V修饰而获得。A42L取代挽救了Y50Nva十聚体的活性。由于:i)更加有限的AICD;ii)由于在I类MHC上增加的稳定性和/或稍微修饰的与TCR的相互作用,潜在更高的体内活性,所述稍微修饰的与TCR的相互作用可能对于耐受性破坏是重要的,所以,与天然肽相比较,相似的或减少的体外活性(但是保留交叉反应性)的肽类似物仍然有效用于诱导或加强免疫应答。
实施例11
离体评估,应用类似物来引发针对天然表位的增强的免疫性
将3组小鼠(n=4)用表达SSX-241-49天然表位的质粒免疫,在第0,3,14和17天,以25μl PBS中25μg质粒/淋巴结,通过直接接种到腹股沟淋巴结内进行。这之后是在第28和31天的两次额外的肽加强(相似的用量)。免疫的时间安排在图7中显示。加强后一周,将脾细胞用SSX-241-49天然肽离体刺激,并且在不同的E∶T比例针对51Cr标记的靶细胞(T2细胞)进行检测(图8)。所述结果表明,与类似物A42L或野生型肽本身相比,作为加强剂,类似物A42V引发针对表达天然肽的靶细胞的更高的应答。这与通过离体实验确定的结合和稳定参数相关。
实施例12
体内评估,应用类似物来引发针对天然表位的增强的免疫性
将8组小鼠(n=4)用表达SSX-241-49天然表位的质粒免疫,在第0,3,14和17天,以25μl PBS中25μg质粒/淋巴结,通过直接接种到腹股沟淋巴结内进行。这之后是在第28和31天的两次额外的肽加强(相似的用量),其使用阴性对照肽(Melan A 26-35″EAA″),天然肽或类似物,如在图9中所示。
为了评估针对天然肽的体内应答,将脾细胞从同窝出生的对照HHD小鼠分离,并且与20μg/mL或1μg/ml的天然肽一起温育2小时。然后将这些细胞用CFSEhi荧光染色(4.0μM或1μM持续15分钟),并且与用CFSElo荧光(0.4μM)染色的等量的对照脾细胞一起静脉内共同注射到免疫的小鼠中。18小时后,通过从被激发的动物移除脾和PBMC而测定靶细胞的特异性消除,并且通过流式细胞术检测CFSE荧光。相对于对照(未负荷的)群体计算与负荷肽的脾细胞相对应的群体的相对损耗,并且表示为%特异性裂解。图10(脾)和11(血)显示由图7描述的方案激发的体内细胞毒性。相对于天然肽,所检测的肽中有3种,A42V、K41F和K41Y,在脾和血中都表现出针对用20μg/ml以及1μg/ml的天然肽包被的靶细胞的增加的活性(图11)。
实施例13
应用类似物来引发针对肿瘤细胞的增强的应答
将8组小鼠(n=4)用表达SSX-241-49天然表位的质粒免疫,在第0,3,14和17天,以25μl PBS中25μg质粒/淋巴结,通过直接接种到腹股沟淋巴结内进行。这之后是在第28和31天的两次额外的肽加强(相似的用量),其应用阴性对照肽(Melan A 26-35″EAA″),天然肽或类似物,如在图9中所示。
加强后一周,将脾细胞用SSX-241-49野生型肽离体刺激,并且在不同的E∶T比例针对51Cr标记的人肿瘤细胞(624.38黑素瘤细胞)进行检测(图12)。类似物A42V和K41F A42V V49I激发这样的免疫应答,即,其调控针对表达天然SSX-241-49表位的人肿瘤细胞的增加的细胞毒性。
实施例14
N端近端一级锚点修饰(第2个AA)
当检测表3中所示的取代类似物时,与野生型肽表位相比较,所述类似物表现出改善的结合和稳定性模式。然而,对于每种类似物,改善的量级不同,并且,在与HLA-A*0201分子的结合亲和力方面,A42V取代表现出最高的改善。并且,A42V-HLA-A*0201复合体的稳定性比在野生型肽和HLA-A*0201之间形成的复合体更好:T1/2从11.5小时延长至20小时。具有42A到L、V和M取代的肽能够在显著更低的浓度诱导野生型肽特异的CTL的IFN-γ分泌。42A到I取代产生具有改善的结合和稳定性模式的类似物。在P2位置的残基还可以以某种程度参与同TCR的相互作用。这一观察也得到关于42A到Aib类似物的结果的支持,相对于野生型表位,所述类似物具有相似的与HLA-A*0201结合的亲和力。
实施例15
N端二级锚点修饰(第1个AA)
N端二级锚点是在N端的第一个氨基酸。因此,在一个实施方案中,野生型序列中发现的初始Lys 43被更加疏水的和大的氨基酸取代。还可以应用任何更加疏水的和大的氨基酸,包括任何本领域的技术人员可获得的或为本领域的技术人员已知的,包括标准氨基酸和非标准氨基酸。更加疏水的氨基酸的实例包括,但不限于:Phe、Tyr、Trp、和D-Lys。
残基Lys 41定义为与HLA-A*0201分子相互作用中的二级锚定残基,并且它还以某种程度参与同T细胞受体的相互作用。因此,这一位置的修饰可以产生一些不规则的类似物,其更有免疫原性并且更适于肿瘤疫苗的开发。
如在表3所示,可以看出通过将Lys 41置换成为Tyr、Phe或Phe衍生物(苯基甘氨酸、对氟代苯丙氨酸、对硝基苯丙氨酸)所获得的类似物具有同HLA-A*0201分子更高的亲和力,并且形成更稳定的复合体。另一方面,尽管基于所预测的运算法则,Trp类似物应该具有同Tyr和Phe类似物的亲和力相似的亲和力,但是Lys到Trp或Trp衍生物的类似物已表现出同HLA-A*0201分子显著减小的亲和力。实验数据证明了预测运算法则的局限性。例如:Lys 41到Phg取代形成具有同HLA-A*0201分子提高的亲和力和扩大的稳定性的类似物。尽管它与HLA-A*0201分子的亲和力大约与野生型肽的亲和力相同,但是表明对硝基苯丙氨酸类似物在低得多的浓度下诱导野生型肽特异性CTL的IFN-γ分泌。
实施例16
N端一级/二级锚点修饰
当N端的一级和二级锚定残基都被修饰时,一般的趋势是,所获得的类似物表现出与HLA-A*0201分子改善的亲和力和扩大的稳定性(表3),只有少数例外:(K41Y,A42V),(K41Y,A42M)和(K41(D-Lys),A42V)。另外,它们具有非常好的同野生型肽特异性CTL的交叉反应性。将K41W取代与A42V或A42L组合改善了结合/稳定性模式。这些类似物还具有理想的同野生型肽的交叉反应活性。N端一级锚点和二级锚点的组合修饰在更大程度上改变了肽的结构和构象。
实施例17
N端一级/二级锚点和C端一级修饰
野生型肽的C端Val是优选的锚定残基。然而,当它突变成具有一个附加的-CH2基团的Ile时,观察到改善的效果。Val到Abu取代时也观察到相似的改善。其余的类似物表现出同MHC分子改善的结合亲和力和稳定性。这些类似物的结果表明,所述肽C端锚定残基还在T细胞的识别中起重要作用。(表4)
实施例18
N端一级/二级锚点和TCR位点修饰
二级TCR结合氨基酸残基的取代产生不规则的类似物,所述不规则的类似物不妨碍同MHC分子的结合,但是克服了自身抗原的耐受性问题。通过将N端一级/二级锚定残基(K41F和A42V)与TCR位点的取代组合,产生了具有改善的结合亲和力和稳定性的类似物(表6)。这些类似物中的一些在更低的浓度诱导野生型肽特异性CTL的IFN-γ产生,诸如K41F、A42V、E44(Nva)/(Nle)突变体和K41F、A42V、I46L/(Nva)/(Nle)突变体。
实施例19
N端酰胺
用酰胺置换肽的游离羧酸C末端通过赋予对蛋白质水解的稳定性而改善了肽在生物介质中的稳定性,并且赋予针对所述肽的二肽基羧肽酶的抗性。然而,所形成的类似物的一些失去了显著量的它们与MHC分子的亲和力,以及免疫原性和抗原性。出乎意料地,尽管本申请在表7中公开的3种类似物失去了它们与MHC分子的结合能力,但是SSX-241-49-NH2(A42V)保留其与野生型肽特异性CTLs的反应性,如由它在与野生肽的浓度相似的浓度下诱导IFN-γ分泌的能力所表明那样。然而,SSX-241-49-NH2(A42L)能够在更低的浓度刺激IFN-γ的产生。
实施例20
十聚体
典型的MHC结合肽的长度从8-mer到11-mer不等,并且大多数HLA-A*0201结合肽是9-mers或10-mers。在早先的观察中,发现来自天然序列的9-mer和10-mer都具有对于相同MHC的结合基序,并且具有相同的N端。从蛋白酶体处理的观点来看,它们是不同的表位,但是虽然如此还是抗原性交叉反应性的。在野生型表位SSX-241-49的情形中,所述表位是9-mer肽,并且10-mer肽,SSX-241-50,缺少适当的MHC结合基序,并且没有表现出免疫学活性。因此,用可以产生适当的结合基序的氨基酸将野生型表位延长至10-mer。如在表8中所示,尽管许多10-mer类似物具有更低的与HLA-A*0201分子的结合亲和力,但是类似物SSX-241-50(A42L,Y50L/V/Nle/Nva)表现出提高的与HLA-A*0201分子的结合亲和力。特别地,两种10-mer类似物,A42L和Y50 Nle/Nva,能够在比野生型肽更低的浓度下诱导针对野生型肽免疫的T细胞产生IFN-γ。
实施例21
应用类似物克服耐受性(TOLERIZATION)
其中类似物可以代表对于野生型表位的改善的一个方面是在人体系统中增加的免疫原性和耐受性破坏。TCR全体中的差异,不管是由于种系差异还是在阴性选择中的差异,具有给出反常结果的潜力。为了阐明所述问题,将所述类似物用于HLA-A2+血的体外免疫以产生CTL。体外免疫的技术,甚至应用首次用于实验的供体,是本领域已知的,例如,Stauss等.,Proc.Natl.Acad.Sci.USA(美国国家科学院学报)89:7871-7875,1992;Salgaller等.Cancer Res.(癌症研究)55:4972-4979,1995;Tsai等.,J.Immunol(免疫学杂志)158:1796-1802,1997;和Chung等.,J.Immunother.(免疫治疗杂志)22:279-287,1999;其中每一篇通过参考全部并入本申请中。
具体地,通过在Ficoll-Hypaque中离心将来自正常供体的PBMCs从淡黄色包被层中纯化出来。所有的培养物应用自身血浆(AP)进行,以避免暴露于潜在的异种病原体和FBS肽的识别。为了有助于在体外产生肽-特异性的CTL,将自体树突细胞(DCs)用作APCs。产生DCs,并且用DCs和来自PBMCs的肽诱导CTLs,如在Keogh等,2001中描述的那样,其通过参考全部并入本申请中。简要地说,将单核细胞富集的细胞级分用GM-CSF和IL-4培养5天,并且在具有2μg/ml CD40配体的培养基中继续培养2天,以诱导成熟。将2×106个CD8+-富集的T淋巴细胞/孔和2×105个肽-脉冲的DCs/孔在24孔平板中在补充了10%AP、10ng/ml IL-7和20IU/ml IL-2的2ml RPMI中共同培养。在第7和14天将培养物再次用自身辐射的肽-脉冲的DCs刺激。应用本文所描述的体外细胞毒性和细胞因子生产测定而检测免疫原性。
实施例22-30
检测NY-ESO-1
157-165
类似物
检测图13中列出的类似物的活性,诸如结合和生物作用,如在实施例22-30中所述:
实施例22
在单一位置取代的类似物的交叉反应性和功能亲和力(图13A-C)
将上述方法(实施例6)用来检查相对于其天然(或野生型)形式的野生型NY-ESO-1157-165表位而携带单一取代的类似物的文库(图13)。在离体激发IFN-γ产生的最少需要的类似物的量和在类似物的任何浓度产生细胞因子的最大量之间发现强的反相关性。
用F或K取代S157,形成部分保留MHC结合和与对指定表位特异的T细胞的交叉反应性的类似物。用I取代L158改善了肽的免疫学特征,如通过这种方法所评估的那样;而L158V导致活性的部分保持。用氨基酸V、L、A、或I的任何一种修饰C165导致改善的免疫特性。
在N端位置或其它位置具有取代,并且在这一检测中相对于野生型肽而具有保留的但没有增加的活性的肽,可以用于人。另外,它们是用于进一步衍生的材料,以改善它们的特性,如下述所描述的那样。
实施例23
在两个位置取代的类似物的交叉反应性和功能亲和力(图13A-C)
将实施例6的方法用来检查相对于野生型NY-ESO-1157-165表位携带两个取代的类似物的文库。发现在位置2和9同时发生的半保守修饰对类似物的免疫特性具有显著的作用,这取决于所述类似物精确的同一性。将L158I与C165V或C165L组合进一步增加了它们相对于野生型肽的活性。类似地,L158V改善了C165V或C165L类似物的活性,相对于野生型肽,其进一步增加了这样的活性。L158V部分保持了C165A或C165I类似物的活性,表明一级锚定残基双突变的令人感兴趣的效果。类似地,L158I部分保持了C165A类似物的活性。
在位置1和9的同时修饰对类似物的免疫特性具有显著的作用,这取决于所述类似物的精确的同一性。S157Y与位置9的C165Nva(正缬氨酸)或Nle(正亮氨酸)组合导致比单独的S157Y或者野生型肽基本上改善的活性。C165V突变体还挽救了S157Y突变体的活性。在位置9的V-NH2或L-NH2部分挽救了S157Y类似物的活性——然而,A-NH2没有这样的作用。S157F和在第9个位置上的V、L、I、以及更少程度上的A的组合,保持了类似物的强活性,并且由于第一个残基参与同TCR的相互作用,其可以比在位置9的单一突变体更加有用。S157K和在第9个位置上的V、L、I、以及更少程度上的A的组合,保持了类似物的强活性,并且由于第一个残基参与同TCR的相互作用和位置1的K对肽的可溶性的完全有益作用,其可以比在位置9的单一突变体更加有用。
实施例24
在多个位置取代的类似物的交叉反应性和功能亲和力(图13A-C)
将实施例6的方法用来检查相对于野生型NY-ESO-1表位携带多个取代的类似物的文库。
L158Nva或L158Nle极大地改善了S157Y C165V突变体的活性。相对于野生型肽,在位置158的V或I和在165的V、L、A或I之间的组合,部分恢复类似物相对于野生型肽的功效。相对于野生型肽和具有C165V或C165I的S157V,S157Y L158I C165V表现出增加的活性;并且具有C165L或I的S157I,保持了MHC结合和与对野生型肽特异性的T细胞的交叉反应性。
除了在160的L或N;在162的A、L、V、或N;或在164的E、D或T之外,包括分别在位置157和165的Y和V的三元取代,在这种交叉反应性检测中,保持了所述肽的活性,由于位置160、162和164参与同TCR的相互作用,这使得这些类似物成为用于在体内破坏T细胞耐受性的有效化合物。
在实施例2所描述的检测中,包括157F和158V加上位置165的V、L或I的三元取代表现出活性。另外,包括S157F和L158I加上位置165的V或A的三元突变体保持了活性。综合起来,这些数据强调了所述多个取代的复杂的相互作用和非线性的性质。
最后,相对于野生型肽,包括S157W和更高程度的S157T以及158V和165V的三元突变体,分别表现出保持的或者增加的活性。
实施例25
包括野生型肽和在不同位置突变的十聚体的交叉反应性和功能亲和力(图
13A-C)
将实施例6的方法用来检查包括指定的NY-ESO-1157-165肽的十聚体的类似物的文库。尽管所述十聚体本身在体外缺少显著的活性,但是在这一位置的各种取代部分地挽救了活性,诸如在166的L,或者在166的L、I、Nle与在157的Y和在165的V组合。
由于:i)更加有限的AICD(抗原-诱导的细胞死亡);ii)由于在I类MHC上增加的稳定性和/或稍微修饰的与TCR的相互作用而引起的更高的体内活性,所以与野生型肽相比较,在体外具有相似的或减少的活性的肽类似物(但是具有保持的交叉反应性)仍然有效用于诱导或加强免疫应答。因此,这些类似物有效地用于破坏耐受性。
实施例26
评估类似物的免疫学特性:与I类MHC分子结合的肽(图13A-C)
肽类似物和野生型表位与HLA-A*0201的亲和力通过基于T2细胞的检测进行评估(参考Regner M,等.,Exp Clin Immunogenet.(实验临床免疫遗传学)1996;13(1):30-5,其通过参考全部并入本申请中)。对于结合检测,简要地说,将缺少TAP的表达并且因此不在细胞表面装配稳定的I类MHC的T2细胞用不同浓度的肽(对照或类似物)在37℃脉冲处理过夜,充分洗涤,用识别I类MHC(A2等位基因)的荧光标记抗体染色,并且通过FacsScan分析仪运行。结合A2的肽稳定其在细胞表面的存在。在与给定浓度的类似物和阴性对照(非MHC结合肽)相对应的MFI(平均荧光强度)之间的差异,是有多少MHC和肽之间的稳定的复合体在T2细胞表面展示的函数。因此,在肽的限制性浓度,这主要是Kon的测量,并且在肽的饱和水平,是Kon和Koff的测量。
在图13中,所述结合通过两种数学相关的因子而量化:半最大结合(给出50%的与饱和相对应的信号的肽的浓度)和相对亲和力(1/RA),所述相对亲和力是针对参考(野生型肽)标准化的结合——即,在对照相对于肽类似物的半最大结合之间的比例。1/RA指数越高,并且半最大结合越低,类似物和MHC分子之间相互作用的Kon越高。图13中,相对于野生型肽,有39种所述类似物具有改善的这样的结合参数。这样改善的结合物携带在已知参与同MHC和/或TCR相互作用的位置的1个、2个、3个或多个标准和/或非标准氨基酸的取代,对MHC结合的全部作用取决于精确的/缀合的修饰。这样的肽类似物有效用于治疗性组合物或作为进一步衍生治疗性组合物的平台。
实施例27
免疫方法(图14)
将8组小鼠(n=4)用表达野生型NY-ESO-1157-165表位的质粒免疫,在第0,3,14和17天,将每个淋巴结用在25μl PBS中的25μg质粒,通过直接接种到腹股沟淋巴结内而进行。这之后是在第28和31天的两次肽加强(相似的用量),应用阴性对照肽(HBVc),野生肽或类似物,如在图14中所示。
实施例28
在体内评估类似物引发针对野生型表位的增强的免疫性的应用(图15
A-C)
为了评估所获得的针对野生型表位的体内应答,将脾细胞从同窝出生的对照HHD小鼠分离,并且用20μg/mL或1μg/ml的野生型肽温育2小时。然后将这些细胞用CFSEhi和CFSEmed荧光染色(分别为4.0μM或1μM持续15分钟),并且与用CFSElo荧光(0.4μM)染色的等量的对照脾细胞一起静脉内共同注射到免疫的小鼠中。18小时后,通过从被激发的动物移除脾和PBMC而测定靶细胞的特异性消除,并且通过流式细胞术测定CFSE荧光。相对于对照(未负荷的)群体,计算与负荷肽的脾细胞相对应的群体的相对消耗,并且表示为%特异性裂解。图15A显示在接受阴性对照肽的小鼠中缺少体内细胞毒性。图15B显示在用质粒免疫并且用野生型肽增强的小鼠中的可变的细胞毒性。图15C显示在用质粒免疫并且用类似物L158Nva C165V增强的小鼠中的基本上恒定的细胞毒性。
实施例29
在体内评估各种类似物在引发针对野生型表位的增强的免疫性中的比较
(图16A-B)
按照实施例8所述的免疫流程内容和应用实施例9所述的方法,在分别对于引发和增强流程应用质粒和肽类似物进行引发和增强流程后,对针对用有限的(1μM;图16A)或超最适量的野生型肽(20μM;图16B)包被的靶细胞的体内细胞毒性进行评估。表示为平均%特异性裂解+/-SE的结果表明,类似物L158V C165Nva诱导最高的活性,并且类似物L158VC165V,L158V C165Nva和S157K L158V C165V表现出同野生型肽或C165V突变体相同范围的效果。由于多个取代可以改变TCR结合位点,因此,这样的类似物可以比野生型肽在破坏针对自身表位的耐受性中更加有效。另外,S157K三元突变体可以改善野生型肽或具有直接的实际应用的其它类似物的极低的溶解度。
实施例30
通过细胞因子生产离体评估类似物引发针对野生型表位的增强的免疫性
的应用(图17A-B)
按照实施例27所述的免疫流程的内容,并且按照实施例28所述的激发,将脾细胞分离,收集并且在体外用10μM的野生型肽NY-ESO-1157-165分别刺激3和6天。收集上层清液,并且通过ELISA测定IFN-γ浓度。
当离体刺激时,类似物L158Nva C165V更迅速地诱导生产巨大水平的IFN-γ的T细胞(图17A)。其它类似物,诸如S157F L158V C165V,L158VC165Nva,和L158V C165V,在用野生型肽离体再次刺激时,诱导生产增加量的IFN-γ的T细胞(图17B)。相反,相对于野生型肽,按照实施例27-28中所述的流程,C165V没能诱导T细胞生产IFN-γ的增加的能力。
实施例31
通过ELISA表征结合和稳定性(ITOPIA检测)
将用所谓的占位肽(placeholder peptide)负荷的含有I类单体的抗生物素蛋白包被的微量滴定平板用来评估肽的结合、亲和力和解离率(off-rate)。提供单体包被的平板作为iTopia表位发现系统试剂盒(iTopiaEpitope Discovery System Kit)(贝克曼库尔特公司(Beckman Coulter,Inc.),圣地亚哥,加利福尼亚,美国)的部分。检测缓冲液,抗-MHC-FITC mAb和β2-微球蛋白和对照肽也与试剂盒一起提供。
结合检测:
通过结合检测,首先评估天然肽和类似物它们结合每种MHC分子的能力。这一检测测定个体肽在标准化的最适结合条件下结合HLA分子的能力。首先将单体-包被的平板打开(stripped),释放占位肽并且只使MHC重链结合到平板上。然后,在最适折叠条件下,引入检测肽,以及抗MHC-FITC mAb。将平板在21℃温育18小时。抗MHC-FITC mAb优先结合重折叠的MHC复合体。因此,每种肽产生的荧光强度与肽和MHC分子形成复合体的能力相关。相对于试剂盒中提供的阳性对照肽,评估每种肽的结合,并且将结果表示为“%结合”。随后,将相对于天然肽鉴定为‘更好的结合物’的类似物在亲和力和解离率检测中进行分析。
亲和力检测:
对于亲和力检测,在开始去除占位肽后,将给定的等位基因的增加浓度(10-4-10-8M范围)的每种测试肽添加到一系列孔中,并且在前文所述的条件下温育。将平板在荧光计上读数。应用Prism软件产生S形剂量反应曲线。将获得最大值的50%所需要的肽的用量记作ED50值。
解离率检测:
对于解离率检测,在21℃温育18小时后,洗涤平板以去除过量的肽。然后将平板在等位基因特异性的单体平板上在37℃温育。在多个时间点(0,0.5,1,1.5,2,4,6和8小时)测量平板的相对荧光强度。将50%的肽与MHC单体解离所需要的时间定义为T1/2值(小时)。
iScore计算:
iScore是在iTopia软件中提供的多参数计算。它的值是基于结合、亲和力和稳定数据计算的。
实施例32
检验PSMA
288-297
的抗原性
在第0,3,14和17天,将HHD转基因小鼠(n=4)用PSMA288-297肽(每个淋巴结25μg,在25μl PBS中,加上12.5μg的pI:C)免疫。加强后一周,将脾细胞用天然PSMA288-297肽离体刺激,并且在不同的E∶T比例,针对51Cr-标记的人肿瘤细胞(PSMA+A2+LnCap细胞,或作为阴性对照,用I类MHC-封闭的抗体包被的LnCap细胞)进行检测。表示为%特异性裂解(平均值±SEM)的结果,表明PSMA特异性T细胞能够以一种取决于I类MHC可用性的方式裂解人肿瘤细胞,这证实了PSMA表位以一种允许免疫介导的攻击的方式在肿瘤细胞的I类MHC上的展示。
实施例33-38
检测PSMA
288-297
类似物
检测在图19和20中列出的类似物的各种特性,诸如改善的亲和力和结合稳定性,与天然表位的交叉反应性,和免疫原性,如实施例33-38所述。
实施例33
在单一位置取代的类似物的交叉反应性和功能亲和力
应用实施例31所述的方法,彼此互相比较评估PSMA288-297和类似物的结合特征(参见图19)。结合的阳性对照是melan-A26-35A27L。通过应用类似物肽刺激对天然表位特异性的T细胞系分泌IFN-γ,基本上如在实施例6中所述的那样,而评估与天然表位的交叉反应性。图19所示的数据通过用10μg/ml的类似物(大约10μM)刺激而产生。对于所述类似物,这一浓度通常导致最大的或接近最大的IFN-γ产生,并且因此被选作代表交叉反应性。
观察到的类似物的亲和力在图19中报道为ED50s。Met,Ile,Gln,Val,Nva,Nle,和Abu在P2位置取代。这些取代一般导致相似的亲和力。Nle和Met取代还维持了相似的结合稳定性,作为以小时为单位的半解离时间而测定。Val、Nva、和Abu类似物激发相似水平的IFN-γ产生。
在PΩ一级锚定位置用Val、Leu、Nva、和Nle取代Ile。所有这4种具有相似的结合亲和力。Val和Nva取代改善了结合的稳定性,并且增加了生产的IFN-γ的量,这表明交叉反应性并且所述类似物可具有改善的免疫原性。
在P1的Ser、Ala、Sar、和Abu取代维持了相似的结合特征,但是具有边缘相似的交叉反应性。在PΩ-1位置的Ala、Leu、Ser、和Thr取代也维持了相似的结合特征。最后,在P3的Trp取代表现出都增加了大约2倍的亲和力和结合稳定性,以及为天然肽的2倍之内的IFN-γ产量,所有都通常为相似的值。
实施例34
在两个位置取代的类似物的交叉反应性和功能亲和力
上文可见的模式,在这种表位中的取代没能极大地消弱结合亲和力,继续用双取代来检验(图20)与天然肽相比较,哪一种均一地表现出相似的或改善的结合亲和力。在具有在两个一级锚定位置具有取代的类似物中,具有在P2的Nva或Nle与在PΩ的Val,和在P2的Val与在PΩ的Nva的那些类似物显示改善的结合稳定性,并且前两者增加了IFN-γ产生(对于第3种类似物没有显示数据)。在PΩ的Val和Nva取代还与在P1的Ala和Abu取代配对。这些类似物都具有强的结合稳定性,并且与单一的PΩ取代比较,具有提高的IFN-γ产生,因而进一步改善了P1的取代。尽管各种结合参数通常是相似的,但是当与P3 Trp取代组合时,PΩNva取代还能够维持比PΩV更好的交叉反应性。
实施例35
在三个位置取代的类似物的交叉反应性和功能亲和力
在P1、P2、和P3;P1、P2、和PΩ;P2、P3、和PΩ;以及P1、P3、和PΩ进行三元取代(图21)。在所有情形中,P1取代是Ala,P3取代是Trp,以及PΩ取代是Val或Nva。如上,保持了至少同天然肽相似的亲和力。对于P1、P2、P3类,在P2的Nva和Nle改善了结合稳定性。这种P2 Nva类似物激发了相似量的IFN-γ,而Nle类似物表现出基本的增加。
对于P1、P2、PΩ类,以各种组合的在P2和PΩ的Nva和Val改善了结合稳定性。这种P2 Nva PΩ Val类似物还在IFN-γ产生上表现出基本的增加(数据未显示)。在这种三元取代中在P2和PΩ的Val都表现出结合稳定性,和几乎为天然肽的IFN-γ产生的一半的IFN-γ产生。
对于P2、P3、PΩ组,只有Nva/W/V类似物表现出提高的结合或IFN-γ产生。对于所检验的两种P1、P3、PΩ类似物,PΩ为Val或Nva的类似物改善了结合稳定性。
实施例36
各种类似物的交叉反应性免疫原性
在第0,3,14和17天,将HHD转基因小鼠组(n=8)用肽(天然表位PSMA288-297,或携带在一级或二级锚定残基的取代的类似物)免疫,通过直接接种到腹股沟淋巴结中,每个淋巴结施用在25μl PBS中的25μg+12.5μg pI:C而进行。
在最后一次加强后10天,将小鼠处死,制备脾细胞,并且通过ELISPOT分析评估IFN-γ产生。在用抗IFN-γ抗体包被的ELISPOT平板中,将不同数目脾细胞/孔用10μg/ml的天然肽刺激。在温育后48小时,进行检测,并且自动计数识别天然PSMA288-297肽的生产细胞因子的T细胞的频率。数据在图22中作为斑点形成克隆/孔的数目(一式三份平均值±SD)列出。所述数据表明,通过I297V和P290W类似物获得针对天然表位的免疫应答的增加的引发,另一种类似物表现出比天然肽(I297Nva或G288Abu或L289Nle I297Nva)略微更高(但是显著的)活性。在这种程度上,天然表位的弱的免疫原性反映耐受性,这些类似物的改善的活性代表耐受性的破坏。
实施例37
通过I297V类似物增强由质粒诱导的针对PSMA
288-297
的应答
在第0,3,14和17天,将2组HHD转基因小鼠(n=8)用表达PSMA288-297的质粒免疫,通过直接接种到腹股沟淋巴结内,每个淋巴结施用在25μlPBS中的25μg质粒而进行。这之后在第28和31天进行2次肽加强(25μg),使用天然肽或I297V类似物。
在最后一次加强后10天,将小鼠处死,制备脾细胞,并且通过ELISPOT分析评估IFN-γ产生。在用抗IFN-γ抗体包被的ELISPOT平板中,将不同数目脾细胞/孔用10μg/ml的天然肽刺激。在温育后48小时,进行检测,并且自动计数识别天然PSMA288-297肽的生产细胞因子的T细胞的频率。数据在图23中作为针对0.5百万应答细胞标准化的特异性T细胞的频率(一式三份的平均值+SD)列出。所述数据表明,在用I297V类似物免疫的小鼠组中,不论脾细胞数目/孔,天然表位特异性T细胞的频率是极高的。
实施例38
针对人肿瘤细胞的离体细胞毒性
在第0,3,14和17天,将HHD转基因小鼠(n=4)用表达PSMA288-297表位的质粒免疫,通过直接接种到腹股沟淋巴结内,每个淋巴结施用在25μl PBS中的25μg质粒而进行。这之后在第28和31天进行2次肽加强(相同的用量),使用I297V类似物。在加强后一周,将脾细胞用天然PSMA288-297肽离体刺激,并且在不同E∶T比例针对51Cr-标记的人肿瘤细胞(Lncap,A2+PSMA+;或624.38 A2+PSMA-或对照624.28细胞A2-PSMA-)进行过夜检测。所获得的免疫性有效地介导针对LNCAP的细胞毒性(图24)。
实施例39
检验PRAME
425-433
的抗原性
在第0,3,14和17天,将HHD转基因小鼠(n=4)用PRAME425-433肽免疫(每个淋巴结施用在25μl PBS中的25μg肽,加上12.5μg pI:C)。在加强后一周,将脾细胞用天然PRAME425-433肽离体刺激,并且在不同E∶T比例针对51Cr-标记的人肿瘤细胞(PRAME+A2+624.38黑素瘤细胞;或A2表达缺陷的阴性对照624.38细胞)进行检测。表示为%特异裂解(平均值±SEM)的结果表明PRAME-特异性T细胞能够裂解人肿瘤细胞,这证实了PRAME425-433表位在肿瘤细胞的I类MHC上以允许免疫介导的攻击的方式展示(图25)。
实施例40-48
检测PRAME
425-433
类似物
检测图26-28列出的类似物的各种特性,诸如改善的亲和力和结合稳定性,与天然表位的交叉反应性,以及免疫原性,如实施例40-48所述。应用实施例31所述的方法,PRAME425-433和69种类似物的HLA-A*0201结合特征彼此相互比较进行评估。用于结合的阳性对照是melan-A26-35A27L。观察到的类似物的亲和力报道为%结合(与阳性对照相比较)和ED50,和作为半解离时间的结合稳定性。与天然表位的交叉反应性通过应用类似物肽来刺激对天然表位特异的T细胞系分泌IFN-γ而进行评估,基本上如实施例6所述的那样。通过用大约0.3μM的类似物肽刺激而产生图26-28所示的数据。所述结果从3次独立的实验收集而来,并且针对每次实验中由天然肽激发的IFN-γ的量而标准化。在一些情形中,所报道的值是两次确定的平均值。星号“*”表明IFN-γ的产生不能同背景区分开来。
实施例40
在单一位置取代的类似物的交叉反应性和功能亲和力(图26)
对于P2一级锚定位置的Leu进行Val、Met、Ile、Nle、Nva、和Abu的单一取代。所有这些类似物表现出为天然肽的20%之内的%结合。对于Met类似物的ED50具有与天然肽相当的亲和力,而Nva和Ile类似物的亲和力减小了大约3倍以内,但是仍然与PSMA288-287表位相当。所有的P2取代维持了至少与天然肽相似的结合稳定性。Met、Nle、和Nva类似物激发了为天然肽2倍之内的IFN-γ产生,并且Val类似物稍微更少一些。
对于P1位置的Ser,进行Lys、Phe、Tyr、Thr、Orn(鸟氨酸)、和Hse(高丝氨酸)的单一取代。除了超出了上限(high side)的范围的Phe类似物之外,所有这些类似物表现出为天然肽的20%内的%结合。对于Lys类似物的ED50几乎减少6倍,但是其它5种类似物具有为天然肽的3倍内的亲和力。结合稳定性通常与天然肽相似,在这一组中,Phe P1类似物表现出最大的结合稳定性,与天然肽的12.2小时相比,其具有17.7小时的半解离时间。除了Lys P1类似物,其激发天然肽的40%的IFN-γ,由于它们激发为天然肽的2倍内的IFN-γ产生,所以认为所有这些类似物是交叉反应性的。
对PΩ锚定位置进行Val、Ile、Ala、Nle、Nva、Abu的单一取代,以及通过添加酰胺基而修饰羧基端。所有这些类似物表现出为天然肽的20%内的%结合。ED50检测在从少于Ala取代的大于10倍到Nle取代的相当的值的范围;Nva取代和C-端酰胺还在天然肽的ED50的3倍之内。结合稳定性还通常与Nva类似物在高端的异常值相似,t1/2为17.2小时,并且在低端的C-端酰胺具有显著的减少,t1/2只有3小时。Val、Ile、Ala、和Abu PΩ类似物表现出更少优选的交叉反应性,但是其余的类似物激发为天然肽2倍之内的IFN-γ生产。
还进行了在主要影响TCR相互作用位置的单一取代:在P3和P6的Nle、Nva和Abu,以及在P8的Ala、Ser和Sar。P6 Nva类似物产生为天然肽的2倍之内的IFN-γ,尽管P6Abu类似物接近44%。
实施例41
在两个位置取代的类似物的交叉反应性和功能亲和力
应用上述单一取代的不同组合,在P1和P2,P2和PΩ,以及P1和PΩ产生双取代类似物(图27A和27B)。所检验的P1-P2双取代没有一种具有结合亲和力或稳定性的基本变化,但是在IFN-γ检测中没有一种表现出显著的交叉反应性。然而,关于P2-PΩ双取代的类似物观察到相似的模式,在IFN-γ检测中,L426Nva L433Nle类似物表现出显著水平的与天然肽的交叉反应性,以及其相似的、稍微改善的结合特征。最后,对于P1-PΩ双取代,所检验的类似物还符合具有至少相似的结合特征的通用模式,但是在交叉反应性检测中激发可以忽略的IFN-γ。这一组中的例外是S425FL433Nle类似物,其表现出稍微改善的结合稳定性和显著的交叉反应性,并且S425F L433Nle类似物具有多于4倍减少的ED50,几乎加倍的半解离时间,并且比天然肽激发更多的IFN-γ。
实施例42
在三个位置取代的类似物的交叉反应性和功能亲和力
研究了4种三元取代类似物,其具有在P1的Phe或Thr,在P2的Nva或Met,以及在PΩ的Nle。S425T L426M L433Nle类似物具有相似的亲和力,而对于其余3种类似物,亲和力被改善了。具有P2 Nva取代的两种类似物都表现出增加的结合稳定性和显著水平的交叉反应性。参见图28。
实施例43
L426NVA L433NLE类似物的交叉反应免疫原性
在第0,3,14和17天,将2组HH转基因小鼠(n=8)用下述实施例49中所述的表达PRAME425-433的质粒pCTLR2免疫,通过直接接种到腹股沟淋巴结中,每个淋巴结施用在25μl PBS中的25μg质粒而进行。这之后在第28和31天应用天然肽或PRAME表位类似物L426Nva L433Nle进行两次肽加强(2.5μg)。
在最后一次加强后10天将小鼠处死,制备脾细胞,并且在用10μg/ml天然肽体外刺激0.5×106细胞/孔后,评估IFN-γ的产生。在温育后48小时,收集上层清液,并且通过ELISA测定应答PRAME425-433肽而产生的IFN-γ的浓度。所述数据在图29中描述,并且表明在用PRAME425-433L426Nva L433Nle类似物加强的小鼠中IFN-γ产生的显著增加。
实施例44
由L426NVA L433NLE类似物诱导的体内细胞毒性
将2组HHD转基因小鼠(n=8)如上述实施例43所描述的那样进行免疫。
为了评估针对天然表位获得的体内应答,将脾细胞从同窝生的对照HHD小鼠分离,并且与20μg/mL或1μg/ml的天然肽一起温育2小时。然后,将这些细胞用CFSEhi和CFSEmed荧光(分别为4.0μM或1μM,15分钟)染色,并且与用CFSElo荧光(0.4μM)染色的等数目的对照脾细胞一起静脉内共同注射到免疫小鼠中。18小时后,通过从激发的动物移除脾和PBMC,而测定靶细胞的特异性消除,并且通过流式细胞术测定CFSE荧光。相对于对照(未负荷的)群体,计算与负荷肽的脾细胞相对应的群体的相对消耗,并且表示为%特异性裂解。图30的结果表明当类似物取代天然肽作为加强剂时细胞毒性的保守诱导。这一趋势表明所述类似物可以改善细胞毒性免疫性的诱导。
实施例45
体内细胞毒性和四聚体染色
在第0,3,14和17天,将7组HHD转基因小鼠(n=4)用表达PRAME425-433的质粒pCTLR2免疫,通过直接接种到腹股沟淋巴结中,每个淋巴结施用在25μl PBS中的25μg质粒而进行。这之后在第28和31天进行两次肽加强(2.5μg),应用天然肽,阴性对照(EAAGIGILTV肽(SEQID NO.100))或在一级和/或二级锚定残基携带突变的PRAME425-433表位类似物-S425F,L426Nva L433Nle,S425T L433Nle,和S425T L426NvaL433Nle。
为了评估针对天然肽的体内应答,将脾细胞从同窝生的对照HHD小鼠分离,并且与0.2μg/ml或20μg/ml的天然肽一起温育2小时。然后,将这些细胞用CFSE荧光(分别为1和2.5μM,15分钟)染色,并且与用CFSElo荧光(0.4μM)染色的等数目的对照脾细胞一起静脉内共同注射到免疫小鼠中。18小时后,通过从受激发的动物移除脾,而测定靶细胞的特异性消除,并且通过流式细胞术测定所获得的细胞悬浮液中的CFSE荧光。相对于对照(未负荷的)群体,计算与负荷肽的脾细胞相对应的群体的相对消耗,并且表示为%特异性裂解。另外,PRAME425-433-特异性T细胞的频率,通过四聚体/CD8共染色而进行评估。
基于体内细胞毒性和四聚体染色,当与天然肽相比较时,用包括一级或二级锚定残基的突变的类似物加强表现出相当的免疫活性。所述类似物能够增强免疫应答,如通过与用不相关的肽加强的“EAA”组相比较所显示的那样。在这方面,如通过体内细胞毒性所评估的,包括S425F,L33Nle,L426Nva L433Nle,S425T L433Nle,或S425T L426Nva L433Nle的类似物都能够扩大针对天然表位的免疫性。然而,只有L433Nle,L426NvaL433Nle,和S425T L426Nva L433Nle类似物以显著高于用质粒激活并且用阴性对照肽加强的小鼠的水平扩大了针对天然表位特异性的T细胞的亚组(图31)。
实施例46
离体细胞因子产生
在第0,3,14和17天,将3组HHD转基因小鼠(n=4)用表达PRAME425-433的质粒pCTLR2免疫,通过直接接种到腹股沟淋巴结中,每个淋巴结施用在25μl PBS中的25μg质粒而进行。这之后在第28和31天进行两次肽加强(2.5μg),应用PRAME表位类似物L426Nva L433Nle和S425T L426Nva L433Nle或阴性对照肽Melan A(EAAGIGILTV(SEQ IDNO.100))而进行。
在最后一次加强后10天将小鼠处死,制备脾细胞,并且在与10μg/ml天然肽温育后48小时,通过ELISA评估IFN-γ的产生。数据在图32中描述为以pg/ml单位的细胞因子浓度(一式三份的平均值±SD)。所述数据表明,用两种类似物加强的小鼠的脾细胞离体产生细胞因子,并且针对L426Nva L433Nle的应答大于针对S425T L426Nva L433Nle的应答。
实施例47
在用类似物肽加强后针对人肿瘤细胞系的离体细胞毒性
在第0,3,14和17天,将HHD转基因小鼠(n=4)用表达PRAME425-433的质粒pCTLR2免疫,通过直接接种到腹股沟淋巴结中,每个淋巴结施用在25μl PBS中的25μg质粒而进行。这之后在第28和31天进行两次肽加强(2.5μg),其应用类似物L426Nva L433Nle。加强后一周,用天然肽离体刺激脾细胞,并且在不同E∶T比例针对51Cr-标记的人肿瘤细胞(用或没用IFN-γ预处理的PRAME+624.38黑素瘤细胞;或HLA-A2表达缺陷的阴性对照624.38细胞)进行检测。类似物L426Nva L433Nle激发介导针对表达A2(624.38)的人肿瘤细胞的显著的细胞毒性的免疫应答,当它们用IFN-γ预处理时,其稍微地升高。相反,针对A2-624.28对照细胞没有测量到显著的活性。参见图33。
实施例48
针PRAME
425-433
的体外免疫
体外免疫按照图34中列出的通用方案进行。通过Ficoll-分离,从健康的供体(HLA-A*0201+)获得外周血单核细胞(PBMCs)。将新鲜的PBMCs(2.5×106),与5ng/ml PRAME425-433或肽类似物一起接种到T细胞培养基中。随后,在72和96小时后,每孔加入20IU/ml的白介素-2,并且在第7天加入额外的肽(5ng/ml)。在收集效应细胞并且将其用于四聚体染色之前,将培养物继续维持10天。将IVS PBMCs用PRAME425-433四聚体标记,并且在FACSCalibur(BD,圣何塞,加利福尼亚)上进行分析。基于用不相关的HBV四聚体和SSX2四聚体染色的阴性对照,建立象限,并且捕获了最少的10,000的门控事件(gated events)。将四聚体-阳性细胞表示为淋巴细胞群体的百分数。与天然肽相比较,在用肽类似物IVS之后,PRAME425-433-特异性四聚体被显著地增强了。参见图35。这证明所述类似物可以是优选的免疫原。
实施例49
PCTLR2,一种表达PRAME
425-433
表位的质粒
pCTLR2是一种重组DNA质粒疫苗,其编码这样一种多肽,即,所述多肽具有来自PRAME的HLA A2-特异性CTL表位,即氨基酸残基425-433 SLLQHLIGL(SEQ ID NO.71),和PRAME的表位簇区域,即氨基酸422-509。对于质粒中多肽的cDNA序列受控于巨细胞病毒(CMVp)的启动子/增强子序列,当被抗原呈递细胞摄取时,其允许所述多肽的信使的充分转录。在所述编码序列3′端的牛生长激素多聚腺苷酸化信号(BGH polyA)提供用于信使多聚腺苷酸化的信号,以增加其稳定性以及从核到细胞质的转移。为了促进质粒转运到核,将来自猿猴空泡病毒40的核输入序列(NIS)插入到质粒主链中。将一个拷贝的CpG免疫刺激基序构建到质粒中,以进一步加强免疫应答。最后,质粒中的两种原核遗传元件负责在大肠杆菌(E.coli)中的扩增,卡那霉素抗性基因(Kan R)和pMB细菌复制起点(参见图36)。
免疫原翻译产物序列
所编码的多肽的氨基酸序列(长度上为150个氨基酸残基)在下文给出。
malqsllqhliglsnlthvlypvplesyedihgtlhlerlaylharlrellcelgrpsmvwlsanpcphcgdrtfydpepilcpcfmpnkrsllqhliglgdaaysllqhliglispekeeqyiasllqhliglkrpsikrsllqhligl(SEQ ID NO:196).
前89个氨基酸残基是代表PRAME 422-509的表位簇区域。在这一表位簇区域,应用各种表位预测运算法则,已经发现了许多潜在的HLA A2-特异性CTL表位。氨基酸残基90-150是表位释放(SynchrotopeTM)序列,具有嵌入的4个拷贝的PRAME 425-433CTL表位(黑体)。在定义的PRAME CTL表位两侧的是短的氨基酸序列,已表明其在处理PRAMECTL表位中起着重要作用。另外,将氨基酸序列ispekeeqyia(SEQ IDNO.197)(与PRAME氨基酸276-286相对应,斜体)构建到串珠(sting-of-beads)区域,以帮助所编码的多肽表达的检测。
应用各种免疫学测定,包括四聚体、ELISPOT、ELISA、和细胞毒性,从用pCTLR2质粒免疫的HLA-A2转基因小鼠中已经检测到对表位PRAME425-433特异的强CTL应答,这表明pCTLR2的免疫原性功效。这些数据表明,所述质粒被抗原呈递细胞摄取,所编码的多肽被合成,并且被蛋白水解处理,以产生九聚体表位肽,和结合HLA-A2用于呈递的九聚体表位肽。
质粒构建
长的互补寡聚核苷酸系列的逐步连接导致产生编码“串珠”(″String-of-Beads″)表位释放序列(氨基酸90-150)中的氨基酸残基的cDNA。这些cDNA产生用于限制性酶的适当的粘性末端,其可以用于同编码PRAME表位簇区域(氨基酸1-89)的cDNA的进一步连接,所述cDNA通过在作为模板的编码PRAME的cDNA上进行PCR而扩增。然后,将完整的插入片段连接到Afl II和EcoR I位点之间的载体主链中。完整的编码序列通过DNA测序而进行验证。
实施例50
抗原特异性T细胞应答的产生
在没有病原体的条件下,笼养H-2I类-阴性、HLA-A2.1-转基因HHD小鼠,并且用于评估HLA-A2.1-限制性人肿瘤相关的细胞毒性T淋巴细胞(CTL)表位的免疫原性。将8-12周龄的雌性小鼠用于淋巴内免疫,并且用于脾细胞的分离,以用于体内细胞毒性研究。小鼠通过两侧腹股沟淋巴结注射而进行免疫。通过吸入异荧烷而将小鼠麻醉,并且在无菌条件下进行手术。手术准备之后,在腹股沟褶处切开长度为0.5cm的切口,并且暴露出腹股沟淋巴结。应用0.5mL胰岛素注射器,将最大体积25μl(25μg)的质粒DNA疫苗或肽直接注射到所述淋巴结内。伤口用无菌的6-0尼龙皮肤缝线闭合。
实施例51
针对人肿瘤细胞的离体细胞毒性
在第0,3,14和17天,将HHD转基因小鼠(n=4/组)用表达melan-A26-35A27L表位类似物的质粒pSEM(在美国专利申请号10/292,413(公开号20030228634A1)中更充分地描述,其通过引用完全结合于此)进行免疫,通过直接接种到腹股沟淋巴结内,每淋巴结施用在25μl PBS中的25μg质粒而进行。这之后在第28和31天进行两次额外的肽加强(相同用量),使用类似物A27L、A27Nva、或A27L V35Nva进行。加强后一周,将脾细胞离体用天然melan-A26-35肽进行刺激,并且在不同的E∶T比例针对51Cr-标记的人肿瘤细胞(624.38细胞)进行检测。在用A27L或A27Nva类似物加强后获得的免疫性相当于和比天然肽EAAGIGILTV(SEQ ID NO.100)更加有效(图37)。由于所述激活质粒表达A27L类似物,所以本实验对所述肽具有潜在的偏爱。因此,如果激活是利用相同的序列的话,那么用A27Nva类似物获得的基本的细胞毒性可能被低估了其功效。
实施例52
四聚体分析
CD8+抗原-特异性T细胞的计数需要I类MHC/肽复合体同源识别T细胞受体(TCR)。这可以应用I类MHC四聚体进行,其由4个I类HLAMHC分子的复合体组成,每个分子结合到特定的肽上并且与荧光蛋白缀合。因此,四聚体检测允许对给定的与具体的MHC分子复合的肽特异的总T细胞群体的量化。并且,由于结合不依赖功能途径,这一群体包括所有特异的CD8+T细胞,而不论功能状态。通过用HLA-A*0201 MART1(ELAGIGILTV(SEQ ID NO.100))-PE MHC四聚体(贝克曼 库尔特(Beckman Coulter),TO 1008)或酪氨酸酶369-377(YMDGTMSQV(SEQ IDNO.94))特异的四聚体试剂(HLA-A*0201酪氨酸酶-PE,贝克曼库尔特)和FITC缀合的大鼠抗小鼠CD8a(Ly-2)单克隆抗体(BD生物科学(Biosciences)),将密度离心(哺乳动物淋巴细胞分离液(LympholyteMammal),Cedarlane实验室)后从外周血分离的单核细胞共染,而测定免疫动物的CTL应答。应用BD FACS Calibur流式细胞仪收集数据,并且应用cellquest软件通过门控淋巴细胞群体进行分析,并且计算CD8+CTL群体内四聚体+细胞的百分数。
实施例53
四聚体染色(质粒激活,肽加强——天然相对类似物)
在第0,3,14和17天,将两组HHD转基因小鼠(n=8)用表达酪氨酸酶369-377的质粒免疫,通过直接接种到腹股沟淋巴结内,每个淋巴结施用在25μl PBS中的25μg质粒而进行。这之后在第28和31天进行两次额外的肽加强(相似用量),使用天然肽或377Nva类似物进行。10天后,应用酪氨酸酶369-377特异的四聚体试剂(HLA-A*0201酪氨酸酶-PE,贝克曼库尔特),而监测免疫应答。将个体小鼠通过眼眶后窦静脉采血,并且应用2000rpm持续25分钟的密度离心(哺乳动物淋巴细胞分离液,Cedarlane实验室)分离PBMC。将PBMC用小鼠对CD8特异的抗体(BD生物科学(Biosciences))和酪氨酸酶四聚体试剂一起共染色,并且通过应用FACS口径流式细胞仪(BD生物科学(Biosciences))的流式细胞术确定具体的百分数。酪氨酸酶特异的CD8+细胞百分数,表明用类似物代替天然肽保持了酪氨酸酶特异的亚组的扩展。所述趋势表明所述类似物可以改善酪氨酸特异的T细胞的扩展(图38)。
实施例54
体内细胞毒性和四聚体染色
(天然肽和全体类似物候选物之间的逐一比较)
在第0,3,14和17天,将4组HHD转基因小鼠(n=6)用表达酪氨酸酶369-377和Melan-A26-35A27L表位的质粒(pSEM)免疫,通过直接接种到腹股沟淋巴结内,每个淋巴结施用在25μl PBS中的25μg质粒而进行。这之后在第28和31天进行两次肽加强(相似用量),将Melan-A26-35A27L加入到左侧腹股沟淋巴结内,并且将携带在一级和/或二级锚定残基的取代的酪氨酸酶369-377类似物接种到右侧淋巴结内。将仅用质粒免疫的小鼠或首次用于实验的小鼠用作对照。
为了评估针对天然酪氨酸酶和MelanA表位的体内应答,将脾细胞从同窝生的对照HHD小鼠分离,并且分别独立地与20μg/ml的天然肽(Melan-A26-35或酪氨酸酶369-377)一起温育2小时,温育在没有HL-1血清的培养基(Cambrex)中进行,浓度为20×106细胞/mL。然后,将这些细胞用CFSE(Vybrant CFDA SE细胞示踪试剂盒,分子探针(MolecularProbes))(分别为1和2.5μM,15分钟)染色,并且与用CFSElo荧光(0.4μM)染色的等数目的对照没有肽包被的脾细胞一起静脉内共同注射到免疫小鼠或首次用于实验的对照HHD小鼠中。18小时后,通过从激发的动物移除脾,并且通过流式细胞术测定所获得的细胞悬浮液中的CFSE荧光,而测定靶细胞的特异性消除。相对于对照(未负荷的)群体,计算与负荷肽的脾细胞相对应的群体的相对消耗,并且将其表示为%特异性裂解。另外,酪氨酸酶369-377和Melan-A26-35-特异性T细胞的频率,通过四聚体/CD8共染色(HLA-A*0201-四聚体,贝克曼库尔特(Beckman Coulter))而进行评估。
酪氨酸酶类似物V377Nva能够扩增酪氨酸酶-特异的T细胞群体,并且增强细胞毒性免疫性,与天然肽相似并且大于酪氨酸酶类似物M370VV377Nva(图39)。
实施例55
针对人肿瘤细胞的离体细胞毒性
在第0,3,14和17天,将HHD转基因小鼠(n=4/组)用表达酪氨酸酶369-377表位的质粒(pSEM)免疫(按照图40的一般流程),通过直接接种到腹股沟淋巴结内,每个淋巴结施用在25μl PBS中的25μg质粒而进行。这之后在第28和31天进行两次肽加强(相同用量),使用天然肽或携带在一级锚定残基P2和PΩ(370和377)取代的类似物。加强后一周,将脾细胞离体用天然酪氨酸酶369-377肽刺激,并且在不同的E∶T比例针对51Cr-标记的人肿瘤细胞(624.38细胞)进行检测。天然肽和M370V V377Nva类似物都产生了针对624.38细胞的强细胞毒性(图41)。尽管对于天然肽存在某些稀释的细胞溶解活性,但是对于所述类似物不存在这样的活性,这进一步证实了从实施例52的四聚体结果所获得的更大的免疫原性的指示。与前述实施例综合来看,这一观察阐明了用更灵敏的检测(体外刺激后离体细胞毒性)补充更严谨的检测(体内细胞毒性和四聚体染色)对提出潜在有效的类似物的有效性。
实施例56
通过ITOPIA系统表征天然肽和类似物的结合和稳定性(半衰期)
由于与MHC 1复合体结合的肽的结合和稳定性是获得良好的免疫应答所必要的,所以应用iTopia表位发现系统(还在实施例31中讨论)检测天然表位及其类似物与A0201限制性1类MHC分子的结合和稳定性(T1/2)。对于6种天然表位和设计成增强免疫应答的它们的类似物确定结合和解离率(offrate)(T1/2)。所示天然肽和类似物如下:NY-ESO-1157-165,NY-ESO-1157-165(L158Nva,C165V),Melan-A26-35,Melan-A26-35(A27Nva),SSX-241-49,SSX-241-49(A42V),Prame425-433,Prame425-433(L426Nva,L433Nle),酪氨酸酶369-377,酪氨酸酶369-377(V377Nva),PSMA288-297和PSMA288-297(I297V)。
表10(下述)显示六种类似物及它们的天然肽的肽结合和稳定性或半衰期的平均值。与天然肽相比,SSX-241-49和NY-ESO-1157-165的类似物表现出结合百分数的显著增加。与天然肽相比,Melan-A26-35、Psma288-297、Prame425-433和酪氨酸酶369-377的类似物表现出肽的结合百分数的少量增加。
与天然肽相比,Melan A26-35(A27Nva)表现出稳定性(半衰期)的显著增加。对于其它类似物Psma288-297(I297V),NY-ESO-1157-165(L158Nva,C165V),Prame425-433(L236Nva,L433Nle)和SSX-241-47(A42V)观察到稳定性的显著增加。与天然肽相比,在类似物酪氨酸酶369-377(V377Nva)的半衰期没有观察到显著的不同。在类似物的半衰期中观察到的不同可能是由于每种类似物与MHC 1分子结合的机制的差异。
表10.天然肽及其类似物的结合百分数和稳定性(半衰期)的平均值
| # | 肽名 | 半衰期(T1/2) | %在TO的肽结合 |
| 1 | Melan-A 26-35 | 1.85 | 74 |
| 2 | Melan-A 26-35(A27Nva) | 13.55 | 79 |
| 3 | PSMA 288-297 | 7.34 | 85 |
| 4 | PSMA 288-297(I297V) | 16.72 | 92 |
| 5 | Nyeso-1 157-165 | 12.74 | 63 |
| 6 | Nyeso-1 157-165(L158Nva,C165V)) | 16.98 | 100 |
| 7 | PRAME 425-433 | 12.42 | 79 |
| 8 | Prame 425-433(L426Nva,L433Nle) | 16.87 | 89 |
| 9 | SSX2 41-49 | 9.90 | 55 |
| 10 | SSX2 41-49(A42V) | 15.01 | 71 |
| 11 | 酪氨酸酶369-377 | 14.39 | 73 |
| 12 | 酪氨酸酶369-377(V377Nva) | 14.74 | 77 |
上文所述的各种方法和技术提供了许多实行本发明的方法。当然,应该理解,按照本申请所述的任何具体的实施方案,没有必要实现所述所有的目的或益处。因此,例如,本领域的那些技术人员应该意识到,所述方法可以以实现或优化本申请所教导的一种益处或一组益处而不必实现本申请教导或提示的其它目的或益处的方式进行。许多有益的和不利的备选方案在本文提及。应该理解,一些优选的实施方案特异性地包括一个、另一个、或一些有利的特征,而其它实施方案特异性地排除一个、另一个或一些不利特征,而其它实施方案通过包括一个、另一个或一些有利特征而特异性地减少不利特征的出现。
并且,熟练的技术人员应该意识到不同的实施方案的各种特征的适应性。类似地,上文所讨论的各种组成部分、特征和步骤,以及每种这样的组成部分、特征或步骤的其它已知的等价物,可以由本领域的普通技术人员混合并且匹配,以按照本申请所述的原理实行方法。在各种组成部分、特征和步骤中,在不同的实施方案中,一些将被特异性地包含在内,而另一些将被特异性地排除在外。
尽管已经在某些实施方案和实施例中公开了本发明,本领域的技术人员应该理解,本发明超出具体公开的实施方案延伸到其它备选的实施方案和/或应用及其改进和等价物。
已经公开了许多本发明的变化和备选的组成部分。其它变化和备选的组成部分对于本领域的技术人员应该是显而易见的。在这些变化中,没有限制,为在筛选全体中或由治疗产品靶向的抗原的具体数目、抗原的类型、癌症的类型、和指定的具体抗原。本发明的各种实施方案可以特异性地包括或排除任何这些变化或组成部分。
在一些实施方案中,应该理解,用来描述并且要求本发明的特定的实施方案的表示成分的量的数目、特性诸如分子量、反应条件等在一些实例中通过术语“大约”而修正。因此,在一些实施方案中,在撰写的描述和后附的权利要求中列出的数字参数是可以依据具体的实施方案寻找要获得的需要的特性而变化的近似值。在一些实施方案中,所述数字参数应该依据所报道的显著数字的数目并且通过应用常规凑整技术进行解释。尽管在本发明的一些实施方案的宽范围中列出的数字范围和参数是近似的,但是在具体实施例中列出的数值同实际一样精确地报道。在本发明的一些实施方案中描述的数值可以含有由在它们各自的检测测定中发现的标准偏差导致的必要的某些错误。
在一些实施方案中,在描述本发明的具体的实施方案的上下文中(特别是在特定的下述权利要求的上下文中)的术语“一个”和“一种”和“所述”以及类似的指示物可以解释为包括单数和复数。在本文中值的范围的引用仅仅是意欲作为单独提及落入所述范围的每一个单独的值的速记方法。除非在本文另外指明,每一单独的值如同它单独在本文中引用一样而结合在说明书中。除非本文另外指明或者与上下文另外明显地相抵触,本文所述的所有方法可以以任何适当的顺序实行。关于本文某些实施方案提供的任何以及所有实施例、或示例性语言(例如,“诸如”)的应用只是意欲更好地举例说明本发明,而不是对另外要求的本发明的范围造成限制。说明书中没有语言应该被解释为指示任何未要求的对实施本发明重要的组成部分。
本文所公开的发明的备选组成部分或实施方案的组合不应该被解释为限制。每一组成员可以单独或与本文发现的组的其它成员或其它组成部分任何组合地提及并且要求。由于便利和/或可专利性的缘故,预计组的一个或多个成员可以包含在组内或者从组删除。当发生任意所述包含或删除时,此处认为本说明书包含改进的组,因此满足在后附的权利要求中所用的所有Markush组的撰写描述。
在本文中描述了本发明的优选的实施方案,包括本发明人已知的实行本发明的最好的模式。当阅读前述描述时,关于这些优选的实施方案的变化对于本领域的普通技术人员是显而易见的。应该考虑到,熟练的技术人员可以适当地应用所述变化,并且本发明可以以与本文特异描述不同地实行。因此,按照适用的法律允许,本发明的许多实施方案包括在其后附的权利要求中引用的主题的所有改进和等价物。并且,在其所有可能的变化中的上述组成部分的任何组合包含在本发明中,除非本文另外指明或者通过上下文另外明显地抵触。
此外,在贯串本说明书中,许多参考参见专利和印刷的出版物。上文引用的参考文献和印刷的出版物的每一个分别通过引用完全并入本申请中。
最后,应该理解,本文公开的发明的实施方案是举例说明本发明的原理。可以应用的其它改进可以在本发明范围之内。因此,通过举例的方式,但是不限于此,可以按照本文的教导应用本发明的备选配置。因此,本发明不限于精确所示和所描述的那些。
Claims (69)
1.一种分离的肽,其基本上由下述序列组成,其中:
P0是X,XX,或XXX,其中X指定任何氨基酸或没有氨基酸;和
P1是S,K,F,Y,T,Orn,或Hse;和
P2是L,V,M,I,Nva,Nle或Abu;和
P3是L,Nva,Nle或Abu;和
P4是Q;和
P5是H;和
P6是L,Nva,Nle或Abu;和
P7是I;和
P8是G,A,S,或Sar;和
在P9的PΩ是L,V,I,A,Nle,Nva,Abu,或L-NH2;并且
PΩ+1是X,XX,或XXX,其中X指定任何氨基酸或没有氨基酸;并且
其中所述序列不是SLLQHLIGL(SEQ ID NO:71)。
2.权利要求1的分离的肽,其基本上由下述序列组成:
{K,F,Y,T,Orn,或Hse}LLQHLIGL(SEQ ID NO:72);或
S{V,M,I,Nva,Nle,或Abu}LQHLIGL(SEQ ID NO:73);或
SL{Nva,Nle或Abu}QHLIGL(SEQ ID NO:74);或
SLLQH{Nva,Nle或Abu}IGL(SEQ ID NO:75);或
SLLQHLI{A,S,或Sar}L(SEQ ID NO:76);或
SLLQHLIG{V,I,A,Nle,Nva,Abu,或L-NH2}(SEQ ID NO:77);或
{F,Y,T,Orn,或Hse}{Nva,Nle,M,或I}LQHLIGL(SEQ IDNO:78);或
S{Nva,Nle,或M}LQHLIG{Nva,Nle,或V}(SEQ ID NO:79);或
{K,F,Y,T,Orn,或Hse}LLQHLIGV(SEQ ID NO:80);或
{F或T}LLQHLIG{Nle}(SEQ ID NO:81);或
{F或T}{Nva或M}LQHLIG{Nle}(SEQ ID NO:82)。
3.权利要求2的分离的肽,其基本上由下述序列组成:
{F,Y,T,Orn,或Hse}LLQHLIGL(SEQ ID NO:83);或
S{Nva,Nle,或M}LQHLIGL(SEQ ID NO:84);或
SLLQHLIG{Nle,Nva,或L-NH2}(SEQ ID NO:85);或
SLLQH{Nva或Abu}IGL(SEQ ID NO:86);或
S{Nva}LQHLIG{Nle}(SEQ ID NO:87);或
{F或T}{L或Nva}LQHLIG{Nle}(SEQ ID NO:88)。
4.权利要求3的分离的肽,其基本上由下述序列组成:
S{L或Nva}LQHLIG{Nle}(SEQ ID NO:89);或
T{Nva}LQHLIG{Nle}(SEQ ID NO:90)。
5.权利要求4的分离的肽,其基本上由下述序列组成:
S{Nva}LQHLIG{Nle}(SEQ ID NO:87)。
6.权利要求1的分离的肽,其中所述肽具有对于I类MHC肽结合裂口的亲和力。
7.权利要求6的分离的肽,其中所述I类MHC是HLA-A2。
8.一种分离的肽,其包括在序列SLLQHLIGL(SEQ ID NO:71)中的1至3个取代,具有对于I类MHC结合裂口的亲和力,所述亲和力相似于或大于SLLQHLIGL(SEQ ID NO:71)对于所述I类MHC结合裂口的亲和力。
9.权利要求8的分离的肽,其中半解离时间相似于或者大于SLLQHLIGL(SEQ ID NO:71)从所述I类MHC结合裂口的半解离时间。
10.权利要求8的分离的肽,其被具有对于肽SLLQHLIGL(SEQ IDNO:71)的特异性的T细胞识别。
11.I类MHC/肽复合体,其中所述肽具有权利要求1的肽的序列。
12.权利要求11的I类MHC/肽复合体,其与识别I类MHC/PRAME425-433复合体的TCR交叉反应。
13.权利要求12的I类MHC/肽复合体,其中所述I类MHC/复合体是HLA-A2/PRAME425-433复合体。
14.一种多肽,其包括包埋在释放序列内的权利要求1的肽序列。
15.一种免疫原性组合物,其包括权利要求1的肽。
16.一种免疫原性组合物,其包括权利要求14的多肽。
17.编码权利要求14的多肽的核酸。
18.用于表达权利要求1的肽的核酸工具。
19.一种免疫原性组合物,其包括权利要求17或18的核酸。
20.一种诱导、维持、或增强CTL应答的方法,其包括结节内施用权利要求15的组合物。
21.一种引发I类MHC-限制性T细胞应答的方法,其包括结节内施用权利要求15的组合物和免疫强化剂。
22.一种诱导、维持、或引发CTL应答的方法,其包括结节内施用权利要求19的组合物。
23.一种分离的肽,其基本上由下述序列组成,其中:
P0是X,XX,或XXX,其中X指定任何氨基酸或没有氨基酸;和
P1是G,A,S,Abu,或Sar;和
P2是L,M,I,Q,V,Nva,Nle,或Abu;和
P3是P或W;和
P4是S;和
P5是I;和
P6是P;和
P7是V;和
P8是H;和
P9是P,A,L,S,或T;和
在P10的PΩ是I,L,V,Nva,或Nle;和
PΩ+1是X,XX,或XXX,其中X指定任何氨基酸或没有氨基酸;并且
其中所述序列不是GLPSIPVHPI(SEQ ID NO.42)。
24.一种分离的肽,其基本上由下述序列组成:
{S,Sar,或Abu}LPSIPVHPI(SEQ ID NO.43);或
G{M或Nle}PSIPVHPI(SEQ ID NO.44);或
G{L,I,Nva,或Nle}WSIPVHPI(SEQ ID NO.45);或
GLWSIPVHP{Nva或V}(SEQ ID NO.46);或
GLPSIPVH{A或S}I(SEQ ID NO.47);或
GLPSIPVHP{V,L,Nva,或Nle}(SEQ ID NO.48);或
G{Nle}PSIPVHP{Nva,或Nle}(SEQ ID NO.49);或
G{Nva}PSIPVHP{Nva}(SEQ ID NO.50);或
G{V,Nva,或Nle}PSIPVHPV(SEQ ID NO.51);或
{Sar或Abu}LPSIPVHP{V或Nva}(SEQ ID NO.52);或
A{V,I,Nva,或Nle}WSIPVHPI(SEQ ID NO.53);或
AVPSIPVHP{V或Nva}(SEQ ID NO.54);或
A{Nva}PSIPVHPV(SEQ ID NO.55);或
ALWSIPVHP{V或Nva}(SEQ ID NO.56);或
GVWSIPVHP{V或Nva}(SEQ ID NO.57);或
G{Nva}WSIPVHPV(SEQ ID NO.58)。
25.一种分离的肽,其基本上由下述序列组成:
{Abu}LPSIPVHPI(SEQ ID NO.59);或
G{V,Nva,或Abu}PSIPVHPI(SEQ ID NO.60);或
GLPSIPVHP{V或Nva}(SEQ ID NO.61);或
GLWSIPVHP{I或Nva}(SEQ ID NO.62);或
G{Nle}PSIPVHP{Nva}(SEQ ID NO.63);或
G{Nle或Nva}PSIPVHPV(SEQ ID NO.64);或
{A或Abu}LPSIPVHP{V或Nva}(SEQ ID NO.65);或
G{Nva}WPSIPVHP{I或V}(SEQ ID NO.66);或
A{Nva或Nle}WSIPVHPI(SEQ ID NO.67);或
A{V或Nva}PSIPVHPV(SEQ ID NO.68)。
26.权利要求25的分离的肽,其基本上由下述序列组成:
{Abu}LPSIPVHPI(SEQ ID NO.59);或
GLPSIPVHP{V或Nva}(SEQ ID NO.61);或
GLWSIPVHPI(SEQ ID NO.69);或
G{Nle}PSIPVHP{Nva}(SEQ ID NO.63)。
27.权利要求26的分离的肽,其基本上由下述序列组成:
GLPSIPVHPV(SEQ ID NO.70)。
28.权利要求23的分离的肽,其中所述肽具有对于I类MHC肽结合裂口的亲和力。
29.权利要求28的分离的肽,其中所述I类MHC是HLA-A2。
30.I类MHC/肽复合体,其中所述肽具有权利要求23的肽的序列。
31.权利要求30的I类MHC/肽复合体,其与识别I类MHC/PSMA288-297复合体的TCR交叉反应。
32.权利要求31的I类MHC/肽复合体,其中所述I类MHC/复合体是HLA-A2/PSMA288-297复合体。
33.一种多肽,其包括包埋在释放序列内的权利要求23的肽序列。
34.一种免疫原性组合物,其包括权利要求23的肽。
35.一种免疫原性组合物,其包括权利要求33的多肽。
36.编码权利要求33的多肽的核酸。
37.用于表达权利要求23的肽的核酸工具。
38.一种免疫原性组合物,其包括权利要求36或37的核酸。
39.一种诱导、维持、或增强CTL应答的方法,其包括结节内施用权利要求34的组合物。
40.一种引发I类MHC-限制性T细胞应答的方法,其包括结节内施用权利要求33的组合物和免疫强化剂。
41.一种诱导、维持、或引发CTL应答的方法,其包括结节内施用权利要求38的组合物。
42.一种分离的肽,其包括在序列GLPSIPVHPI(SEQ ID NO.42)中的1至3个取代,具有对于I类MHC结合裂口的亲和力,所述亲和力相似于或大于GLPSIPVHPI(SEQ ID NO.42)对于所述I类MHC结合裂口的亲和力。
43.权利要求42的分离的肽,其中所述半解离时间相似于或者大于GLPSIPVHPI(SEQ ID NO.42)从所述I类MHC结合裂口的半解离时间。
44.权利要求42的分离的肽,其被具有对于肽GLPSIPVHPI(SEQ IDNO.42)的特异性的T细胞识别。
45.由pSEM质粒表达的免疫原性肽的分离的肽类似物,其基本上由下述序列组成:
E{A,L,Nva,Nle}AGIGILT{V,Nva,Nle}(SEQ ID NO:91);或
Y{M,V,Nva,Nle}DGTMSQ{V,Nva,Nle}(SEQ ID NO:92);
并且其中所述序列不是E{A,L}AGIGILTV(SEQ ID NO:93)或
YMDGTMSQV(SEQ ID NO:94)。
46.权利要求45的分离的肽类似物,其中所述肽类似物选自由下列各项组成的组:ELAGIGILTNva(SEQ ID NO:95),ENvaAGIGILTV(SEQID NO:96),YVDGTMSQNva(SEQ ID NO:97),YVDGTMSQV(SEQ IDNO:98)和YMDGTMSQNva(SEQ ID NO:99)。
47.权利要求46的分离的肽类似物,其基本上由氨基酸序列ENvaAGIGILTV(SEQ ID NO:96)组成。
48.权利要求46的分离的肽类似物,其基本上由序列YMDGTMSQNva(SEQ ID NO:99)组成。
49.权利要求45的分离的肽类似物,其中所述肽具有对于I类MHC肽结合裂口的亲和力。
50.权利要求49的分离的肽类似物,其中所述I类MHC是HLA-A2。
51.一种分离的肽类似物,其包括在序列EAAGIGILTV(SEQ ID NO:100)中的1至3个取代,具有对于I类MHC结合裂口的亲和力,所述亲和力相似于或大于EAAGIGILTV(SEQ ID NO:100)对于所述I类MHC结合裂口的亲和力。
52.权利要求51的分离的肽,其中所述半解离时间相似于或者大于EAAGIGILTV(SEQ ID NO:100)从所述I类MHC结合裂口的半解离时间。
53.权利要求51的分离的肽,其被具有对于肽EAAGIGILTV(SEQ IDNO:100)的特异性的T细胞识别。
54.一种分离的肽类似物,其包括在序列YMDGTMSQV(SEQ ID NO:94)中的1至3个取代,具有对于I类MHC结合裂口的亲和力,所述亲和力相似于或大于YMDGTMSQV(SEQ ID NO:94)对于所述I类MHC结合裂口的亲和力。
55.权利要求54的分离的肽,其中所述半解离时间相似于或者大于YMDGTMSQV(SEQ ID NO:94)从所述I类MHC结合裂口的半解离时间。
56.权利要求54的分离的肽,其被具有对于肽YMDGTMSQV(SEQID NO:94)的特异性的T细胞识别。
57.一种I类MHC/肽复合体,其中所述肽具有权利要求1的肽的序列。
58.权利要求57的I类MHC/肽复合体,其与识别I类MHC/Melan-A26-35复合体的TCR交叉反应。
59.权利要求58的I类MHC/肽复合体,其中所述I类MHC/复合体是HLA-A2/Melan-A26-35复合体。
60.权利要求57的I类MHC/肽复合体,其与识别I类MHC/酪氨酸酶369-377复合体的TCR交叉反应。
61.权利要求60的I类MHC/肽复合体,其中所述I类MHC/复合体是HLA-A2/酪氨酸酶369-377复合体。
62.一种多肽,其包括包埋在释放序列内的权利要求45的肽序列。
63.一种免疫原性组合物,其包括权利要求45的任一种肽。
64.一种免疫原性组合物,其包括权利要求62的多肽。
65.编码权利要求62的多肽的核酸。
66.一种免疫原性组合物,其包括权利要求65的核酸。
67.一种诱导、维持、或增强CTL应答的方法,其包括结节内施用权利要求63的组合物。
68.一种引发I类MHC-限制性T细胞应答的方法,其包括结节内施用权利要求63的组合物和免疫强化剂。
69.一种诱导、维持、或引发CTL应答的方法,其包括结节内施用权利要求66的组合物。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US69188905P | 2005-06-17 | 2005-06-17 | |
| US60/691,889 | 2005-06-17 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN101273056A true CN101273056A (zh) | 2008-09-24 |
Family
ID=37571207
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNA2006800300090A Pending CN101273056A (zh) | 2005-06-17 | 2006-06-16 | 表位类似物 |
Country Status (12)
| Country | Link |
|---|---|
| US (5) | US7511118B2 (zh) |
| EP (4) | EP1896498B1 (zh) |
| JP (1) | JP2008543314A (zh) |
| KR (1) | KR20080028938A (zh) |
| CN (1) | CN101273056A (zh) |
| AU (1) | AU2006259307B2 (zh) |
| BR (1) | BRPI0611793A2 (zh) |
| CA (1) | CA2612494A1 (zh) |
| IL (2) | IL188108A (zh) |
| MX (1) | MX2007015951A (zh) |
| NZ (2) | NZ564359A (zh) |
| WO (1) | WO2006138562A2 (zh) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103124740A (zh) * | 2010-09-21 | 2013-05-29 | 美国卫生和人力服务部 | 抗-ssx-2 t细胞受体和相关材料及使用方法 |
| CN107266552A (zh) * | 2016-03-30 | 2017-10-20 | 广州市香雪制药股份有限公司 | 源自于prame的肿瘤抗原短肽 |
| WO2020063488A1 (zh) * | 2018-09-26 | 2020-04-02 | 广东香雪精准医疗技术有限公司 | 一种识别ssx2抗原的t细胞受体 |
| WO2021036924A1 (zh) * | 2019-08-23 | 2021-03-04 | 广东香雪精准医疗技术有限公司 | 一种识别ssx2抗原的高亲和力tcr |
Families Citing this family (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6977074B2 (en) * | 1997-07-10 | 2005-12-20 | Mannkind Corporation | Method of inducing a CTL response |
| US7178491B2 (en) * | 2003-06-05 | 2007-02-20 | Caterpillar Inc | Control system and method for engine valve actuator |
| PL1833506T3 (pl) * | 2004-12-29 | 2016-01-29 | Mannkind Corp | Zastosowanie kompozycji zawierających różne antygeny związane z nowotworem jako szczepionek przeciwnowotworowych |
| AU2005321905A1 (en) * | 2004-12-29 | 2006-07-06 | Mannkind Corporation | Methods to bypass CD+4 cells in the induction of an immune response |
| CA2592922A1 (en) * | 2004-12-29 | 2006-07-06 | Mannkind Corporation | Methods to trigger, maintain and manipulate immune responses by targeted administration of biological response modifiers into lymphoid organs |
| ES2413079T3 (es) | 2005-06-17 | 2013-07-15 | Mannkind Corporation | Métodos y composiciones para desencadenar respuestas inmunitarias multivalentes contra epítopos dominantes y subdominantes expresados en células cancerosas y estroma tumoral |
| EP1896498B1 (en) * | 2005-06-17 | 2014-12-24 | MannKind Corporation | Epitope analogues |
| US8084592B2 (en) * | 2005-06-17 | 2011-12-27 | Mannkind Corporation | Multivalent entrain-and-amplify immunotherapeutics for carcinoma |
| US20080014211A1 (en) * | 2006-07-14 | 2008-01-17 | Mannkind Corporation | Methods to elicit, enhance and sustain immune responses against MHC class I-restricted epitopes, for prophylactic and therapeutic purposes |
| EP2462947B1 (en) * | 2007-03-26 | 2019-03-13 | Academisch Ziekenhuis Leiden h.o.d.n. LUMC | PRAME derived peptides and immunogenic compositions comprising these |
| US20090131355A1 (en) * | 2007-05-23 | 2009-05-21 | Adrian Ion Bot | Multicistronic vectors and methods for their design |
| PL219335B1 (pl) * | 2008-07-04 | 2015-04-30 | Inst Biotechnologii I Antybiotyków | Pochodna insuliny lub jej farmaceutycznie dopuszczalna sól, jej zastosowanie oraz zawierająca ją kompozycja farmaceutyczna |
| AU2010310468A1 (en) | 2009-10-23 | 2012-05-24 | Mannkind Corporation | Cancer immunotherapy and method of treatment |
| AU2010322415B2 (en) * | 2009-11-18 | 2015-06-11 | Mannkind Corporation | Monoclonal antibodies and diagnostic uses thereof |
| WO2012023033A2 (en) | 2010-08-18 | 2012-02-23 | Purdue Pharma L.P. | Improved peptide immunogens |
| EP3222720A1 (en) * | 2011-09-01 | 2017-09-27 | University of Southern California | Methods for preparing high throughput peptidomimetics, orally bioavailable drugs and compositions containing same |
| EP3817757A4 (en) * | 2018-07-06 | 2022-05-18 | The Regents of the University of California | PEPTIDE-DEFICIENT CLASS I CHAPERONE/MHC PROTEIN COMPOSITIONS AND METHODS |
| US11814420B2 (en) | 2018-07-06 | 2023-11-14 | The Regents Of The University Of California | Peptide deficient-MHC class I/chaperone compositions and methods |
| US11421015B2 (en) | 2020-12-07 | 2022-08-23 | Think Therapeutics, Inc. | Method of compact peptide vaccines using residue optimization |
| US11058751B1 (en) | 2020-11-20 | 2021-07-13 | Think Therapeutics, Inc. | Compositions for optimized RAS peptide vaccines |
| US11161892B1 (en) | 2020-12-07 | 2021-11-02 | Think Therapeutics, Inc. | Method of compact peptide vaccines using residue optimization |
| US11464842B1 (en) | 2021-04-28 | 2022-10-11 | Think Therapeutics, Inc. | Compositions and method for optimized peptide vaccines using residue optimization |
| IL308257A (en) | 2021-05-05 | 2024-01-01 | Immatics Biotechnologies Gmbh | Antigen binding proteins that uniquely bind PRAME |
Family Cites Families (60)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US590501A (en) | 1897-09-21 | Xxhixotoh | ||
| US2606601A (en) | 1948-12-14 | 1952-08-12 | Knoll Associates | Chair having a back rest in the form of a shell-like body |
| JP2528457B2 (ja) * | 1987-03-09 | 1996-08-28 | サントリー株式会社 | 過酸化水素の定量法 |
| US6417165B1 (en) | 1988-03-27 | 2002-07-09 | Ludwig Institute For Cancer Research | NY-ESO-1-peptide derivatives, and uses thereof |
| US5804381A (en) | 1996-10-03 | 1998-09-08 | Cornell Research Foundation | Isolated nucleic acid molecule encoding an esophageal cancer associated antigen, the antigen itself, and uses thereof |
| EP1757694A3 (en) | 1992-11-05 | 2008-02-27 | Sloan Kettering Institute For Cancer Research | Prostate-specific membrane antigen |
| US5747271A (en) | 1992-12-22 | 1998-05-05 | Ludwig Institute For Cancer Research | Method for identifying individuals suffering from a cellular abnormality some of whose abnormal cells present complexes of HLA-A2/tyrosinase derived peptides, and methods for treating said individuals |
| US5620886A (en) | 1993-03-18 | 1997-04-15 | Ludwig Institute For Cancer Research | Isolated nucleic acid sequence coding for a tumor rejection antigen precursor processed to at least one tumor rejection antigen presented by HLA-A2 |
| US5935818A (en) | 1995-02-24 | 1999-08-10 | Sloan-Kettering Institute For Cancer Research | Isolated nucleic acid molecule encoding alternatively spliced prostate-specific membrane antigen and uses thereof |
| US5874560A (en) * | 1994-04-22 | 1999-02-23 | The United States Of America As Represented By The Department Of Health And Human Services | Melanoma antigens and their use in diagnostic and therapeutic methods |
| US5830753A (en) | 1994-09-30 | 1998-11-03 | Ludwig Institute For Cancer Research | Isolated nucleic acid molecules coding for tumor rejection antigen precursor dage and uses thereof. |
| US6025191A (en) | 1995-06-07 | 2000-02-15 | Ludwig Institute For Cancer Research | Isolated nucleic acid molecules which encode a melanoma specific antigen and uses thereof |
| US6548064B1 (en) | 1997-05-05 | 2003-04-15 | Ludwig Institute For Cancer Research | Isolated peptides consisting of amino acid sequences found in SSX or NY-ESO-1 molecules, which bind to HLA molecules |
| US6025470A (en) | 1997-06-23 | 2000-02-15 | Ludwig Institute For Cancer Research | Isolated nona- and decapeptides which bind to HLA molecules, and the use thereof |
| ATE325619T1 (de) | 1997-07-10 | 2006-06-15 | Mannkind Corp | Vorrichtung zur induktion einer ctl-antwort |
| US6994851B1 (en) | 1997-07-10 | 2006-02-07 | Mannkind Corporation | Method of inducing a CTL response |
| US6977074B2 (en) | 1997-07-10 | 2005-12-20 | Mannkind Corporation | Method of inducing a CTL response |
| US20030138808A1 (en) | 1998-02-19 | 2003-07-24 | Simard John J.L. | Expression vectors encoding epitopes of target-associated antigens |
| US6709844B1 (en) | 2000-11-16 | 2004-03-23 | Mannkind Corporation | Avoidance of undesirable replication intermediates in plasmid propagation |
| US20020072493A1 (en) | 1998-05-19 | 2002-06-13 | Yeda Research And Development Co. Ltd. | Activated T cells, nervous system-specific antigens and their uses |
| IL125608A0 (en) | 1998-07-30 | 1999-03-12 | Yeda Res & Dev | Tumor associated antigen peptides and use of same as anti-tumor vaccines |
| KR100955668B1 (ko) | 1999-02-05 | 2010-05-06 | 더 유니버시티 오브 멜버른 | T 헬퍼 세포 에피토프 |
| US6605711B1 (en) | 1999-11-15 | 2003-08-12 | Ludwig Institute For Cancer Research | NY-ESO-1 peptide derivatives, and uses thereof |
| US7462354B2 (en) * | 1999-12-28 | 2008-12-09 | Pharmexa Inc. | Method and system for optimizing minigenes and peptides encoded thereby |
| EP1118860A1 (en) | 2000-01-21 | 2001-07-25 | Rijksuniversiteit te Leiden | Methods for selecting and producing T cell peptide epitopes and vaccines incorporating said selected epitopes |
| MXPA02008219A (es) | 2000-02-23 | 2005-06-30 | Epimmune Inc | Peptidos que enlazan hla y sus usos. |
| US20030215425A1 (en) | 2001-12-07 | 2003-11-20 | Simard John J. L. | Epitope synchronization in antigen presenting cells |
| US6861234B1 (en) | 2000-04-28 | 2005-03-01 | Mannkind Corporation | Method of epitope discovery |
| CA2425648A1 (en) * | 2000-10-19 | 2002-04-19 | Epimmune Inc. | Hla class i and ii binding peptides and their uses |
| BR0100425C2 (pt) | 2001-01-12 | 2003-12-02 | Daniel Villares Lenz Cesar | Filtro autolimpante |
| JP2005505242A (ja) | 2001-03-07 | 2005-02-24 | マンカインド コーポレイション | 癌用抗新生血管系調製物 |
| JP3830382B2 (ja) | 2001-03-14 | 2006-10-04 | 日本碍子株式会社 | セラミック焼結体およびその製造方法 |
| WO2003008537A2 (en) * | 2001-04-06 | 2003-01-30 | Mannkind Corporation | Epitope sequences |
| US20030017134A1 (en) | 2001-06-19 | 2003-01-23 | Technion Research And Development Foundation Ltd. | Methods and pharmaceutical compositions for immune deception, particularly useful in the treatment of cancer |
| US7076244B2 (en) | 2001-07-23 | 2006-07-11 | Research In Motion Limited | System and method for pushing information to a mobile device |
| DE60238864D1 (de) | 2001-11-07 | 2011-02-17 | Mankind Corp | Für epitope von antigenen kodierende expressionsvektoren und verfahren zu deren konzeption |
| WO2003076585A2 (en) * | 2002-03-08 | 2003-09-18 | Board Of Regents, The University Of Texas System | Controlled modulation of amino acid side chain length of peptide antigens |
| US20040063120A1 (en) * | 2002-07-10 | 2004-04-01 | The Regents Of The University Of Michigan | Expression profile of lung cancer |
| US20040019571A1 (en) | 2002-07-26 | 2004-01-29 | Intel Corporation | Mobile communication device with electronic token repository and method |
| US20070105779A1 (en) | 2002-07-31 | 2007-05-10 | Danila Valmori | Isolated, ssx-2 and ssx-2 related peptides useful as hla binders and ctl epitopes, and uses thereof |
| TR201900937T4 (tr) * | 2002-08-28 | 2019-02-21 | Dyax Corp | Organların ve dokuların muhafaza edilmesine yönelik yöntem. |
| US20040180354A1 (en) | 2002-09-06 | 2004-09-16 | Simard John J.L. | Epitope sequences |
| EP2356999A1 (en) | 2003-06-17 | 2011-08-17 | Mannkind Corporation | Compositions to elicit, enhance and sustain immune responses against MHC class I-restricted epitopes, for prophylactic or therapeutic purposes |
| WO2004112825A2 (en) | 2003-06-17 | 2004-12-29 | Mannkind Corporation | Combinations of tumor-associated antigens for the treatment of various types of cancers |
| US20060159689A1 (en) | 2004-06-17 | 2006-07-20 | Chih-Sheng Chiang | Combinations of tumor-associated antigens in diagnostics for various types of cancers |
| WO2006009919A2 (en) | 2004-06-17 | 2006-01-26 | Mannkind Corporation | Improved efficacy of immunotherapy by integrating diagnostic with therapeutic methods |
| US20060008468A1 (en) | 2004-06-17 | 2006-01-12 | Chih-Sheng Chiang | Combinations of tumor-associated antigens in diagnostics for various types of cancers |
| AU2005265182B2 (en) | 2004-06-17 | 2012-06-21 | Mannkind Corporation | Epitope analogs |
| US20080206270A1 (en) * | 2004-07-08 | 2008-08-28 | Minev Boris R | Enhancing Class I Antigen Presentation With Synthetic Sequences |
| CA2592922A1 (en) | 2004-12-29 | 2006-07-06 | Mannkind Corporation | Methods to trigger, maintain and manipulate immune responses by targeted administration of biological response modifiers into lymphoid organs |
| PL1833506T3 (pl) | 2004-12-29 | 2016-01-29 | Mannkind Corp | Zastosowanie kompozycji zawierających różne antygeny związane z nowotworem jako szczepionek przeciwnowotworowych |
| AU2005321905A1 (en) * | 2004-12-29 | 2006-07-06 | Mannkind Corporation | Methods to bypass CD+4 cells in the induction of an immune response |
| US20060165711A1 (en) | 2004-12-29 | 2006-07-27 | Bot Adrian I | Methods to elicit, enhance and sustain immune responses against MHC class I-restricted epitopes, for prophylactic or therapeutic purposes |
| EP1896498B1 (en) * | 2005-06-17 | 2014-12-24 | MannKind Corporation | Epitope analogues |
| ES2413079T3 (es) | 2005-06-17 | 2013-07-15 | Mannkind Corporation | Métodos y composiciones para desencadenar respuestas inmunitarias multivalentes contra epítopos dominantes y subdominantes expresados en células cancerosas y estroma tumoral |
| US8084592B2 (en) | 2005-06-17 | 2011-12-27 | Mannkind Corporation | Multivalent entrain-and-amplify immunotherapeutics for carcinoma |
| KR101718768B1 (ko) | 2009-12-21 | 2017-03-22 | 삼성전자주식회사 | 휴대용 단말기에서 전력 소모를 줄이기 위한 장치 및 방법 |
| US9469902B2 (en) | 2014-02-18 | 2016-10-18 | Lam Research Corporation | Electroless deposition of continuous platinum layer |
| US9814289B2 (en) | 2015-04-08 | 2017-11-14 | Otter Products, Llc | Protective folio case for an electronic device |
| EP3636238B1 (en) | 2018-10-12 | 2021-04-28 | Liko Research & Development AB | Gates with transition ramps for overhead lifting rails |
-
2006
- 2006-06-16 EP EP06784999.2A patent/EP1896498B1/en not_active Not-in-force
- 2006-06-16 NZ NZ564359A patent/NZ564359A/en not_active IP Right Cessation
- 2006-06-16 NZ NZ590125A patent/NZ590125A/en not_active IP Right Cessation
- 2006-06-16 AU AU2006259307A patent/AU2006259307B2/en not_active Ceased
- 2006-06-16 CA CA002612494A patent/CA2612494A1/en not_active Abandoned
- 2006-06-16 US US11/454,633 patent/US7511118B2/en not_active Expired - Fee Related
- 2006-06-16 MX MX2007015951A patent/MX2007015951A/es active IP Right Grant
- 2006-06-16 US US11/455,278 patent/US7511119B2/en not_active Expired - Fee Related
- 2006-06-16 EP EP11155676A patent/EP2371851A3/en not_active Withdrawn
- 2006-06-16 BR BRPI0611793-7A patent/BRPI0611793A2/pt not_active IP Right Cessation
- 2006-06-16 US US11/454,300 patent/US7605227B2/en not_active Expired - Fee Related
- 2006-06-16 KR KR1020087001200A patent/KR20080028938A/ko not_active Application Discontinuation
- 2006-06-16 EP EP11155692A patent/EP2371852A3/en not_active Withdrawn
- 2006-06-16 EP EP11155668A patent/EP2371850A3/en not_active Withdrawn
- 2006-06-16 JP JP2008517145A patent/JP2008543314A/ja active Pending
- 2006-06-16 WO PCT/US2006/023489 patent/WO2006138562A2/en active Application Filing
- 2006-06-16 CN CNA2006800300090A patent/CN101273056A/zh active Pending
-
2007
- 2007-12-13 IL IL188108A patent/IL188108A/en not_active IP Right Cessation
-
2009
- 2009-03-17 US US12/406,022 patent/US20100303842A1/en not_active Abandoned
-
2010
- 2010-12-13 IL IL209963A patent/IL209963A0/en unknown
-
2012
- 2012-05-25 US US13/481,741 patent/US8653237B2/en not_active Expired - Fee Related
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103124740A (zh) * | 2010-09-21 | 2013-05-29 | 美国卫生和人力服务部 | 抗-ssx-2 t细胞受体和相关材料及使用方法 |
| CN103124740B (zh) * | 2010-09-21 | 2015-09-02 | 美国卫生和人力服务部 | 抗-ssx-2t细胞受体和相关材料及使用方法 |
| CN107266552A (zh) * | 2016-03-30 | 2017-10-20 | 广州市香雪制药股份有限公司 | 源自于prame的肿瘤抗原短肽 |
| CN107266552B (zh) * | 2016-03-30 | 2022-02-08 | 香雪生命科学技术(广东)有限公司 | 源自于prame的肿瘤抗原短肽 |
| WO2020063488A1 (zh) * | 2018-09-26 | 2020-04-02 | 广东香雪精准医疗技术有限公司 | 一种识别ssx2抗原的t细胞受体 |
| US11649270B2 (en) | 2018-09-26 | 2023-05-16 | Xlifesc, Ltd. | T-cell receptor recognizing SSX2 antigen |
| WO2021036924A1 (zh) * | 2019-08-23 | 2021-03-04 | 广东香雪精准医疗技术有限公司 | 一种识别ssx2抗原的高亲和力tcr |
Also Published As
| Publication number | Publication date |
|---|---|
| NZ564359A (en) | 2011-09-30 |
| EP1896498B1 (en) | 2014-12-24 |
| IL188108A0 (en) | 2008-03-20 |
| US20070060518A1 (en) | 2007-03-15 |
| CA2612494A1 (en) | 2006-12-28 |
| US20100303842A1 (en) | 2010-12-02 |
| US20070060524A1 (en) | 2007-03-15 |
| KR20080028938A (ko) | 2008-04-02 |
| EP2371852A2 (en) | 2011-10-05 |
| IL209963A0 (en) | 2011-02-28 |
| AU2006259307B2 (en) | 2012-12-20 |
| EP2371851A2 (en) | 2011-10-05 |
| EP2371851A3 (en) | 2012-08-01 |
| EP2371850A3 (en) | 2012-08-01 |
| EP1896498A2 (en) | 2008-03-12 |
| US7511118B2 (en) | 2009-03-31 |
| JP2008543314A (ja) | 2008-12-04 |
| MX2007015951A (es) | 2008-03-07 |
| US20130017213A1 (en) | 2013-01-17 |
| US7511119B2 (en) | 2009-03-31 |
| US8653237B2 (en) | 2014-02-18 |
| EP2371852A3 (en) | 2012-08-01 |
| EP2371850A2 (en) | 2011-10-05 |
| NZ590125A (en) | 2012-07-27 |
| AU2006259307A1 (en) | 2006-12-28 |
| BRPI0611793A2 (pt) | 2009-01-13 |
| IL188108A (en) | 2015-03-31 |
| WO2006138562A2 (en) | 2006-12-28 |
| US20070049533A1 (en) | 2007-03-01 |
| US7605227B2 (en) | 2009-10-20 |
| WO2006138562A3 (en) | 2007-07-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN101273056A (zh) | 表位类似物 | |
| JP5166025B2 (ja) | エピトープアナログ | |
| CN101711280A (zh) | Tem8肽和包含tem8肽的疫苗 | |
| CN102119169A (zh) | Iqgap3表位肽及包含它的疫苗 | |
| CN101001868A (zh) | 表位类似物 | |
| CN102264897A (zh) | Rab6kifl/kif20a表位肽及包含它的疫苗 | |
| AU2013201661A1 (en) | Epitope Analogues | |
| NZ583226A (en) | Epitope analogs |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1122823 Country of ref document: HK |
|
| C12 | Rejection of a patent application after its publication | ||
| RJ01 | Rejection of invention patent application after publication |
Application publication date: 20080924 |
|
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: WD Ref document number: 1122823 Country of ref document: HK |