CN1276252C - 有核红细胞的测量方法 - Google Patents
有核红细胞的测量方法 Download PDFInfo
- Publication number
- CN1276252C CN1276252C CN02814528.3A CN02814528A CN1276252C CN 1276252 C CN1276252 C CN 1276252C CN 02814528 A CN02814528 A CN 02814528A CN 1276252 C CN1276252 C CN 1276252C
- Authority
- CN
- China
- Prior art keywords
- blood sample
- erythroblast
- potpourri
- blood
- report
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 238000000034 method Methods 0.000 title claims abstract description 124
- 210000003743 erythrocyte Anatomy 0.000 title claims abstract description 30
- 238000005259 measurement Methods 0.000 title description 7
- 210000004369 blood Anatomy 0.000 claims abstract description 202
- 239000008280 blood Substances 0.000 claims abstract description 202
- 210000000265 leukocyte Anatomy 0.000 claims abstract description 58
- 210000004027 cell Anatomy 0.000 claims abstract description 38
- 230000002101 lytic effect Effects 0.000 claims abstract description 38
- 108010054147 Hemoglobins Proteins 0.000 claims abstract description 29
- 102000001554 Hemoglobins Human genes 0.000 claims abstract description 29
- 238000004820 blood count Methods 0.000 claims abstract description 27
- 210000000601 blood cell Anatomy 0.000 claims abstract description 26
- 239000000203 mixture Substances 0.000 claims abstract description 21
- 239000000463 material Substances 0.000 claims abstract description 12
- 210000003924 normoblast Anatomy 0.000 claims description 77
- 238000009826 distribution Methods 0.000 claims description 47
- 230000002452 interceptive effect Effects 0.000 claims description 11
- 238000010521 absorption reaction Methods 0.000 claims description 10
- 238000010790 dilution Methods 0.000 claims description 10
- 239000012895 dilution Substances 0.000 claims description 10
- 150000003839 salts Chemical class 0.000 claims description 9
- 230000004069 differentiation Effects 0.000 claims description 7
- 230000001915 proofreading effect Effects 0.000 claims description 7
- 206010059484 Haemodilution Diseases 0.000 claims description 4
- 230000015572 biosynthetic process Effects 0.000 claims description 3
- 238000012937 correction Methods 0.000 claims description 3
- 239000003153 chemical reaction reagent Substances 0.000 abstract description 10
- 238000002847 impedance measurement Methods 0.000 abstract description 5
- 230000002934 lysing effect Effects 0.000 abstract 2
- 238000002943 spectrophotometric absorbance Methods 0.000 abstract 1
- 239000003795 chemical substances by application Substances 0.000 description 35
- 238000012360 testing method Methods 0.000 description 15
- 238000004458 analytical method Methods 0.000 description 13
- 238000000149 argon plasma sintering Methods 0.000 description 10
- 239000002245 particle Substances 0.000 description 10
- 239000007788 liquid Substances 0.000 description 8
- 230000017531 blood circulation Effects 0.000 description 7
- 238000004519 manufacturing process Methods 0.000 description 7
- LZZYPRNAOMGNLH-UHFFFAOYSA-M Cetrimonium bromide Chemical compound [Br-].CCCCCCCCCCCCCCCC[N+](C)(C)C LZZYPRNAOMGNLH-UHFFFAOYSA-M 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- XFXPMWWXUTWYJX-UHFFFAOYSA-N Cyanide Chemical compound N#[C-] XFXPMWWXUTWYJX-UHFFFAOYSA-N 0.000 description 5
- 229960002798 cetrimide Drugs 0.000 description 5
- 239000012749 thinning agent Substances 0.000 description 5
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- -1 alkali metal salt Chemical class 0.000 description 4
- 125000000217 alkyl group Chemical group 0.000 description 4
- 125000004432 carbon atom Chemical group C* 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- 239000012153 distilled water Substances 0.000 description 4
- 238000000684 flow cytometry Methods 0.000 description 4
- 239000012634 fragment Substances 0.000 description 4
- 239000004094 surface-active agent Substances 0.000 description 4
- 238000012546 transfer Methods 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- 241001597008 Nomeidae Species 0.000 description 3
- 229910052783 alkali metal Inorganic materials 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 239000000975 dye Substances 0.000 description 3
- 230000005611 electricity Effects 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 239000003446 ligand Substances 0.000 description 3
- 210000002751 lymph Anatomy 0.000 description 3
- 210000004698 lymphocyte Anatomy 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 210000005259 peripheral blood Anatomy 0.000 description 3
- 239000011886 peripheral blood Substances 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 238000007430 reference method Methods 0.000 description 3
- 125000003831 tetrazolyl group Chemical group 0.000 description 3
- 241000196324 Embryophyta Species 0.000 description 2
- 238000000862 absorption spectrum Methods 0.000 description 2
- 125000003342 alkenyl group Chemical group 0.000 description 2
- 125000000304 alkynyl group Chemical group 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 230000005684 electric field Effects 0.000 description 2
- 230000005284 excitation Effects 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- ILHIHKRJJMKBEE-UHFFFAOYSA-N hydroperoxyethane Chemical compound CCOO ILHIHKRJJMKBEE-UHFFFAOYSA-N 0.000 description 2
- 150000003242 quaternary ammonium salts Chemical class 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- MOEFFSWKSMRFRQ-UHFFFAOYSA-N 2-ethoxyphenol Chemical compound CCOC1=CC=CC=C1O MOEFFSWKSMRFRQ-UHFFFAOYSA-N 0.000 description 1
- LXBGSDVWAMZHDD-UHFFFAOYSA-N 2-methyl-1h-imidazole Chemical compound CC1=NC=CN1 LXBGSDVWAMZHDD-UHFFFAOYSA-N 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N Benzoic acid Natural products OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- 240000006829 Ficus sundaica Species 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 238000004159 blood analysis Methods 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 229960000800 cetrimonium bromide Drugs 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 238000005660 chlorination reaction Methods 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 238000003759 clinical diagnosis Methods 0.000 description 1
- 108700042971 cyanomethemoglobin Proteins 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- VICYBMUVWHJEFT-UHFFFAOYSA-N dodecyltrimethylammonium ion Chemical compound CCCCCCCCCCCC[N+](C)(C)C VICYBMUVWHJEFT-UHFFFAOYSA-N 0.000 description 1
- 238000004043 dyeing Methods 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 210000003979 eosinophil Anatomy 0.000 description 1
- 238000001595 flow curve Methods 0.000 description 1
- 238000002795 fluorescence method Methods 0.000 description 1
- 210000003714 granulocyte Anatomy 0.000 description 1
- 208000014951 hematologic disease Diseases 0.000 description 1
- 150000002460 imidazoles Chemical class 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- XLSZMDLNRCVEIJ-UHFFFAOYSA-N methylimidazole Natural products CC1=CNC=N1 XLSZMDLNRCVEIJ-UHFFFAOYSA-N 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 210000004493 neutrocyte Anatomy 0.000 description 1
- 238000012758 nuclear staining Methods 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 239000013618 particulate matter Substances 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 230000005622 photoelectricity Effects 0.000 description 1
- NNFCIKHAZHQZJG-UHFFFAOYSA-N potassium cyanide Chemical compound [K+].N#[C-] NNFCIKHAZHQZJG-UHFFFAOYSA-N 0.000 description 1
- LOAUVZALPPNFOQ-UHFFFAOYSA-N quinaldic acid Chemical compound C1=CC=CC2=NC(C(=O)O)=CC=C21 LOAUVZALPPNFOQ-UHFFFAOYSA-N 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 238000013374 right angle light scattering Methods 0.000 description 1
- 238000001374 small-angle light scattering Methods 0.000 description 1
- 208000010110 spontaneous platelet aggregation Diseases 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume, or surface-area of porous materials
- G01N15/10—Investigating individual particles
- G01N15/12—Coulter-counters
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/80—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving blood groups or blood types or red blood cells
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume, or surface-area of porous materials
- G01N15/10—Investigating individual particles
- G01N15/14—Electro-optical investigation, e.g. flow cytometers
-
- G01N2015/011—
-
- G01N2015/012—
-
- G01N2015/016—
-
- G01N2015/1024—
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/10—Composition for standardization, calibration, simulation, stabilization, preparation or preservation; processes of use in preparation for chemical testing
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/10—Composition for standardization, calibration, simulation, stabilization, preparation or preservation; processes of use in preparation for chemical testing
- Y10T436/101666—Particle count or volume standard or control [e.g., platelet count standards, etc.]
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/10—Composition for standardization, calibration, simulation, stabilization, preparation or preservation; processes of use in preparation for chemical testing
- Y10T436/107497—Preparation composition [e.g., lysing or precipitation, etc.]
Abstract
本发明涉及一种鉴别和计数血样中的有核红细胞的方法。所述方法包括以下步骤:使用溶解剂溶解血样中的红细胞,在非聚焦血流孔中通过DC阻抗法测量有核血细胞,区分有核红细胞和其他细胞类型,以及报告血样中的有核红细胞。所述方法还包括从剩余血细胞计数中减去有核红细胞和其他干扰物质,并报告血样的校正的白细胞计数。此外,所述方法还包括在预先设定的波长下测量样品混合物的分光光度吸收值并报告血样中的血红蛋白浓度,所述波长为溶解血样后形成的血红蛋白色原的波长。
Description
技术领域
本发明涉及一种鉴定血样中的有核红细胞的方法。更具体地,本发明通过在非聚焦血流孔中测量直流电的阻抗,将有核红细胞与其他细胞类型区分开,并计数血样中的有核红细胞。
背景技术
正常的外周血中含有无核的成熟红细胞。有核红细胞(NRBCs)或成红细胞为未成熟的红细胞。它们通常出现在骨髓中而不出现于外周血中。然而在特定的疾病中,如贫血和白血病,NRBCs也见于外周血中。因此,测量NRBCs具有临床重要性。传统上,鉴别和计数NRBC均由人工进行。该过程包括将血样制成显微镜下可观察的涂片,并对其进行染色,然后对每张涂片进行人工可见分析。NRBC的浓度报告为每100个白细胞的NRBC数量。一般地,计数存在200个白细胞的血样涂片的同一区域中的NRBC数量,并将该数量除以2以表示NRBC的浓度,即NRBC数量/100WBC。该方法极费时,且依赖于涂片的检验员的主观分析。
近年来,出现了一些鉴别NRBCs的荧光流式细胞计的方法。因为这些方法难以依靠细胞的电学或光学性质鉴别NRBC,所以要使用特定的核染色技术将NRBCs与其他细胞类型区分开。
美国专利号5,298,426(授予Inami等)公开了一种鉴别NRBCs的荧光法。该方法使用一号液和二号液进行两步染色。Inami等教导,一号液含有一种成红细胞染料,其可渗透入有核红细胞内,特异地对其核进行染色,然后将NRBCs群体与其他细胞群体区分开,以二维图的方式显示经计算机处理NRBC鉴别结果。
美国专利号5,559,037(授予Kim等)公开了一种可用于NRBCs和白细胞的流式细胞计数分析法。该方法包括溶解全血样中的红细胞和NRBC的胞质,以便将NRBC的核暴露于活体核染剂中,并将该染剂对白细胞的渗透率降到最低,通过测量荧光强度和两个光散射角分析样品。该方法代表了一种三重激发法,该三重激发法阻止细胞碎片中的信号(荧光的和非荧光的),并将位于ALL激发信号以下,但在荧光激发信号(FL3)以上的信号定为NRBCs。ALL是轴向光损失或在入射光的角度为零时检测到的光散射信号。因此,该方法需要一维以上的预选通信号来鉴别NRBC群体。此外,该方法还需要将反应物加热至42℃以便区分NRBC与白细胞。
美国专利号5,648,225(授予Kim等)公开了一种使用多用溶解剂鉴别有核血细胞亚型的方法。该方法包括以下步骤:使用含有核染料的多用溶解剂溶解血样,在较高温度下对样品混合物进行孵育,并使用自动光电血液仪对有核血细胞包括NRBCs进行鉴定。
美国专利号5,879,900(授予Kim等)公开了一种使用流式细胞计鉴别血样中NRBCs、破坏的白细胞(WBC)、WBC以及白细胞分类的方法。该方法包括以下步骤:溶解血样;使用活体核染剂对NRBCs和任何破坏的白细胞进行染色;通过测量至少一个荧光强度值和在0度至1度和3度至10度的范围内的至少一个光散射信号,分析样品混合物;根据荧光强度和光散射信号建立三维图;并鉴别和计数WBC、NRBC、破坏的WBC和WBC亚型分类。
EP1 004 880 A2公开了鉴别和计数有核红细胞的试剂和方法。该方法包括以下步骤:溶解红细胞,对白细胞和NRBCs进行染色,通过测量至少一个散射光参数和至少一个荧光强度参数分析样品。
美国专利号5,874,310(授予Li等)公开了一种鉴别有核红细胞的方法。该方法包括以下步骤:溶解成熟红细胞;通过测量光散射强度分析流槽中的样品来区分NRBCs和其他细胞类型。所述测量光散射强度使用了两个小于10度的小角度光散射信号。该方法还包括通过电学和光学分析同时对白细胞进行鉴别,其中电学分析是指DC阻抗测量。
美国专利号5,917,584(授予Li等)公开了一种鉴别有核红细胞的方法。该方法包括以下步骤:溶解血样中的成熟红细胞;通过测量两个光散射角度分析流槽中的样品以区分NRBCs和其他细胞类型,其中第二个光散射信号是中角度或直角光散射信号。
以上描述的方法通过荧光流式细胞计数和光散射测量法对NRBCs和白细胞进行了鉴别和计数。然而,荧光和光散射测量是技术复杂、价格昂贵的检测方法。
现在许多非荧光自动血液分析仪,如Abbott Cell-Dyn3500,COULTERGen*STM,Bayer Advia*120和SysmexTM NE-9000,当仪器感受到获得的细胞分布图中的邻近血细胞碎片区域的信号数量增加时,只能提供NRBC可能存在于待分析血样中的NRBC标志信号。然而,这样的技术经常出现假阳性信号,因为许多其他血液疾病也可引起同区域内的信号增加,如血小板凝集和镰刀形细胞,以及未完全溶解的血样中的红细胞碎片。在这些方法中,不能明确地鉴别出NRBCs。可替代地,仪器只能识别分布图或点图中常见的NRBC样品分布模式,该模式可能与上述的其他原因产生的相似模式混淆。
进一步地,含有NRBC的样本的公知问题是血液分析仪报错样本中白细胞的数目(WBC)。由于NRBC核的体积与白细胞的核的体积相近,测量血细胞大小的血液分析仪通常将其作为白细胞计数,致使WBC的数目增加。因此,对含有NRBC的样品需要校正NRBC部分对血液分析仪报告的WBC的影响。目前临床实验室的做法是从血液分析仪中报告的WBC计数中减去人工计数所得的NRBC数值。该过程既耗时又容易出错。
另一方面,测量血样中的血红蛋白(Hgb)浓度是血液分析的一个组成部分,这对于疾病的诊断和监控医疗反应有重要意义。使用同样的试剂并同时测量完成多重诊断分析是可取的,所述多重诊断分析包括血样中有核红细胞的计数和血红蛋白浓度的测定。
在许多公知的测定血红蛋白的方法中,国际血液学标准委员会(International Committee for Standardization in Hematology)推荐氰化正铁血红蛋白法作为标准方法。但试剂废弃物中的氰化物会引起诸多环境问题。最近十年中,科学家们努力致力于开发不使用氰化物的自动血红蛋白分析法。
美国专利号5,242,832(授予Sakata)公开了一种使用不含氰化物的溶解剂,计数白细胞和测定血样中的血红蛋白浓度。PCT/US95/02897(授予Kim)公开了一种使用不含氰化物的方法和试剂测量全血样中的血红蛋白。Kim未涉及白细胞计数也未涉及有核红细胞的鉴别。美国专利号5,763,280和5,882,934(授予Li等)公开了一种不含氰化物的试剂,该试剂用于测量血样中血红蛋白,计数白细胞和鉴别白细胞亚群。然而,上述的血红蛋白测量方法无一能将有核红细胞从其他细胞类型中鉴别出来。
依上所述,需要一种简单而且价格较低的鉴别并计数有核红细胞的分析法。而且,期望一种能够在同一个检测中同时进行有核血细胞的计数,区分有核红细胞和其他细胞类型,以及测量血红蛋白浓度的多功能检测法。
发明内容
在一个实施方式中,本发明涉及一种区分血样中有核红细胞和其他细胞类型的方法。该方法包括以下步骤:将血样与溶解剂混合以溶解红细胞并形成血样混合物;在非聚焦血流孔内测量血样混合物的DC阻抗,并得到血样混合物的血细胞分布;区分有核红细胞和其他细胞类型;报告血样中的有核红细胞数量。该非聚焦血流孔的长宽比为0.7或0.7以上。报告有核红细胞包括报告血样中有核红细胞的存在,和报告血样中相对于每100个白细胞的有核红细胞的数量,或单位体积血样中有核红细胞的数目。
在另一实施方式中,本发明涉及一种校正白细胞计数的方法。该方法包括以下步骤:将血样与溶解剂混合以溶解红细胞并形成血样混合物;测量血样混合物的DC阻抗,以得到血细胞分布及剩余血细胞的计数;将有核红细胞和其他干扰物质与白细胞区分开;从剩余血细胞计数中减去有核红细胞和其他干扰物质;及报告血样中校正的白细胞计数。该方法还包括报告血样中的有核红细胞。
在另一实施方式中,本发明涉及一种能够同时鉴别有核红细胞,计数白细胞并测量血样中血红蛋白浓度的方法。该方法包括以下步骤:将血样与溶解剂混合以溶解红细胞并形成血样混合物;测量血样混合物的DC阻抗,以得到血细胞分布及剩余血细胞的计数;将有核红细胞和其他干扰物质与白细胞区分开;从剩余血细胞计数中减去有核红细胞和其他干扰物质;在预先设定的波长下测定所述血样混合物的分光光度吸收值,该波长为溶解所述血样后形成的血红蛋白色原的波长;报告血样中的有核红细胞;报告血样中的白细胞数量;并报告血样的血红蛋白的浓度。
附图说明
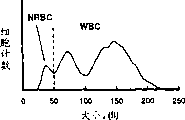
图1A,1B和1C分别是一种正常血样和两种含有有核红细胞的临床上异常血样的DC分布图。这些样本根据实施例1所述的步骤进行处理,并使用非聚焦血流孔在试验血液分析仪上进行分析,孔的长为120μ,宽为100μ。
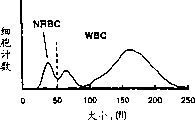
图2A和2B显示一种正常血样和一种含有有核红细胞的临床样品的分布图。该样品根据实施例2所述的步骤进行处理,并使用非聚焦血流孔在试验血液分析仪上进行分析,孔的长为70μ,宽为100μ。
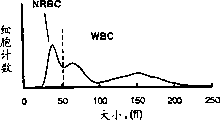
图3A和3B显示一种含有有核红细胞的临床样品的分布图,该样品根据实施例1所述的步骤进行处理,并使用非聚焦血流孔在两台试验血液分析仪上进行分析,孔的大小分别为长120μ,宽100μ和长85μ,宽70μ。
图4A显示一种全血样的分布图,该样本使用实施例4中的溶解剂组合物并经实施例4所述的步骤获得。图4B显示同种样品的谱图,该样品使用实施例4描述的溶解剂组合物并经实施例4所述的步骤处理。
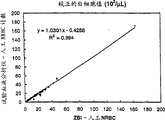
图5A显示通过本发明实施例5描述的方法获得的NRBC浓度和人工参考值之间的相关性。图5B显示通过本发明实施例5描述的方法获得的血红蛋白浓度与从COULTER Gen*S上所得的浓度之间的相关性。图5C显示通过本发明实施例5描述的方法获得的WBC校正值和COULTER COULTERZBI测得的并经人工NRBC计数法校正的WBC值之间的相关性。
图6显示本发明的一种分布图,该图用于区分有核红细胞和白细胞,并进一步鉴别白细胞的亚群,如淋巴和髓样亚群。
具体实施方式
本发明的一个实施方式涉及一种鉴别分析有核红细胞的方法。更具体地,该方法通过测量非聚焦血流孔中的直流电的阻抗,区分血样中的有核红细胞和其他细胞类型。
区分血样中的有核红细胞和其他细胞类型的方法包括如下步骤:将血样与溶解剂混合以溶解红细胞并形成血样混合物;在非聚焦血流孔中测量所述血样混合物的DC阻抗,并获得所述血样混合物的血细胞分布;区分有核红细胞(NRBCs)和其他细胞类型。
为了溶解血样,可以首先用血液稀释剂将血样稀释,然后与足量的溶解剂混合以溶解红细胞。为了本发明的目的,所述血液稀释剂含有足量的一种或多种盐以测量样品混合物的阻抗。适合的盐类的例子为碱金属盐。
血液分析仪通常使用血液稀释剂来稀释血样以测定红细胞,其中的血液稀释剂由盐调节至等渗以保持血细胞的体积。尽管鉴别分析NRBCs并不需要等渗条件,但为了本发明目的,使用市面上出售的等渗血液稀释剂是方便的。
适于与本发明中的血液稀释剂合用的溶解剂包含如下的水溶液:
(a)一种或多种季铵盐,其分子结构如下:
其中R1为具有12至16个碳原子的烷基、烯基或炔基;R2,R3和R4为具有1至4个碳原子的烷基;X-为氯或溴阴离子;
(b)乙氧基化烷基酚,其中烷基具有6至12个碳原子,环氧乙烷的数量在约10至约50之间;和
(c)分子结构如下的乙氧基醇:
R1-R2-(CH2CH2O)n-H
其中R1为具有10至22个碳原子的烷基、烯基或炔基;R2为-O-;n在20和35之间。
合适的季铵盐的例子有:溴化十四烷基三甲基铵、溴化十六烷基三甲基铵和氯化十二烷基三甲基铵。乙氧基醇的适当例子有:新泽西州BASF公司的Plurofac A38 prill表面活性剂和新泽西州Heterene公司的Hetoxol STA-30。乙氧基酚的适当例子有:新泽西州Rhne-Poulenc公司的Igepal SS-837和南卡罗来纳州Chemax公司的Chemax NP-30。
可替换地,所述溶解剂还含有足量的用于测量阻抗的一种或多种盐,该溶解剂可在不另外使用血液稀释剂的条件下溶解血样。适当的盐类的例子为碱金属盐,如硫酸盐,氯化物,磷酸盐和柠檬酸盐。
对NRBCs的鉴别分析在非聚焦血流孔中使用DC阻抗测量法进行。当一个如血细胞这样的颗粒经过该孔时,可测量到由于传导性或阻抗的变化引起的电信号。所述脉冲的形状、高度和宽度直接与颗粒的大小相关,并可转换成所测量的微粒的大小。当测量两种或更多种不同大小的微粒时,所得的分布图即可表示微粒大小的分布。
用配备有DC阻抗测量仪器的血液分析仪检测血细胞数量和大小的方法在美国专利号2,656,508(授予Coulter)和美国专利号3,810,011(授予Coulter等)中有大致描述,这里全部引入作为参考。
已发现孔的长宽比,即孔长与孔宽的比例,影响不同大小的血细胞的分离效果,尤其影响区分NRBC群体与其他有核血细胞。使用本发明的方法,分离NRBC群体与其他类型的细胞可在长宽比为0.7或0.7以上的孔中进行。
已知孔的长宽比影响流经其中的血流曲线,进而影响颗粒在血流中的轨迹。通常,在孔的宽度固定的情况下,血流中心的流速随着孔长的增加而增加。因此,增加孔的长宽比可以增加流速梯度(与孔壁作用的血流接触面流向血流中心方向)。在该流速梯度的影响下,通过孔的血流中的悬浮颗粒会向血流中心移动。因此,在这样的条件下,其中的微粒与通过聚焦血流孔的微粒的行为相似。聚焦血流孔可用于本发明中测量有核血细胞,尤其适于鉴别大小相似的血细胞。然而,聚焦血流孔的成本比非聚焦血流孔的成本要高得多。
另一方面,已知沿着孔的截面,所加电场在截面上的场强不同。由于每个颗粒在孔截面的位置不同,其所处的电场强度也不同,因此,通过非聚焦血流孔的颗粒可以产生不同的脉冲形状。这些脉冲的变形可引起测得的分布图中颗粒大小的分布变异。过去本领域广泛应用脉冲编辑来删除严重变形的脉冲,在一定程度上提高对颗粒大小的鉴别能力。应理解增加孔的长宽比后,沿着从中心至孔壁的方向截面的电场梯度递减。结果由于不经过孔中心的截面的电场更均匀,不经过该孔中心的颗粒产生的电脉冲其变形较小。
因此,增加孔的长宽比带来的两个效应,即控制非聚焦血流孔中颗粒的轨迹和沿孔的截面电场梯度的递减,可增强对不同大小的颗粒的鉴别能力。
已发现使用长宽比为0.7或0.7以上的非聚焦血流孔可以区分NRBC群体与其他大小相近的有核血细胞,尤其是淋巴细胞。优选地,使用长宽比为1.0或1.0以上的孔。更优选地,使用长宽比约为1.2的孔。
进一步增大孔的长宽比,可以更好地将NRBC从其他细胞类型中分离出来。然而,当孔的长宽比为1.5或更大时,对通过测量孔的样品混合物的处理能力显著降低,从而使得测量与血液测量仪的负荷能力不符。因此,应理解在细胞分离和测量负荷平衡的基础上,选用长宽比为1.2的孔最为实际。理论上,长宽比在1.2以上的孔可以用于分离NRBCs与其他类型细胞。
图1A,1B和1C表示血样的DC分布图,该样品经本发明的方法按照实施例1所述的步骤处理,并使用非聚焦血流孔在试验血液分析仪上进行分析,孔的长为120μ,宽为100μ。孔的长宽比为1.2。图1A是一张正常血样的分布图。如图所示,正常的血样经溶解剂溶解红细胞后,有核血细胞显示一种双重模式分布。在本发明中,所有的有核细胞均为白细胞。左峰的主要细胞群为淋巴细胞。在该峰的左侧,分布图区域很干净。
图1B和1C是两份含有有核红细胞的临床异常血样的分布图。图1B和1C所示的血样分别含有由人工参考法测定的230NRBC/100WBC和9NRBC/100WBC。NRBC群作为一个附加峰出现在白细胞的左侧。
图2A和2B分别表示正常血样和含有有核红细胞的临床血样的分布图,其中的样品经实施例2中的步骤处理,并使用非聚焦血流孔进行分析,该孔的长为70μ,宽为100μ。孔的长宽比为0.7。试验血液分析仪与实施例1中使用的分析仪的信号放大比例不同。如图所示,NRBC群体出现在白细胞的左侧。
图3A和3B表示含有有核红细胞的临床血样的分布图,该样品经实施例1所述的方法处理,并如实施例3所述,在两台试验血液分析仪上分析。图3A所示的分布图经非聚焦血流孔分析所得,孔的长为120μ,宽为100μ。图3B所示的分布图经非聚焦血流孔分析所得,孔的长为85μ,宽为70μ。尽管这两种类型的孔在长度和宽度上均不相同,但其长宽比均为1.2。明显地,这两张分布图的类群分布相似。在这两例中,均可实现区分NRBC群体与其他类型的有核细胞。
使用本发明的方法,由于将NRBC群体从其他类型的细胞尤其是白细胞中鉴别出来,所以可以鉴别并报告出所分析样品中NRBC群体的存在。报告血样中临床异常的细胞群体的存在称为血液分析仪的标记,其是支持临床诊断的重要依据。
使用本发明的方法可以进一步计数NRBC群体。当将DC探测器的阈值设定在NRBCs的体积以下时(如图),可同时计数NRBC群体与白细胞。通过DC分布图中群体的分布将NRBC群体从其他细胞类型中鉴别出来后,即可计算出所分析血样中NRBC的浓度。NRBC的浓度以每100个白细胞中NRBC的数量(NRBC/100WBC)表示,与人工参考值的单位相同。可替换地,还可将比率乘以血样中的白细胞计数,以单位体积的血样中的绝对数值代表NRBC数量。
在另一实施方式中,本发明的方法还包括校正白细胞计数。过去白细胞数量是通过直接电阻法测定的,因为未将NRBCs与其他有核血细胞区分开,所以NRBCs的全部或部分也计算在内。NRBCs的干扰可导致白细胞计数的结果增高和错误。本发明中的方法通过鉴别NRBCs,可以从总有核血细胞数量中减去被计入白细胞计数中的NRBCs群体的数目。
此外,已知有些血样比正常血样难以溶解。有些情况下,如果在样品的准备过程中血细胞膜不能充分溶解,其大小不能降至DC探测阈值以下,细胞碎片也会影响白细胞计数。一般地,细胞碎片的体积相对较小,其出现于分布图中NRBCs的左侧。
然而,使用本发明的方法,通过提高了不同细胞类型的分离水平,能更好地分离白细胞和干扰物质,并从样品混合物的剩余血细胞总数中去除干扰物质的影响,因此,通过本方法可以报告得到校正的白细胞数值。
这里所述的术语干扰物质有广泛的含义,其包括任何非白细胞的颗粒物质,但是其存在于血样混合物中,并在测量白细胞的过程中被DC阻抗测量仪计数在内。
在另一实施方式中,本发明还涉及一种同时鉴别有核红细胞并测量血样中血红蛋白浓度的方法。该方法包括以下步骤:(a)将血样与溶解剂混合以溶解红细胞并形成血样混合物;(b)在非聚焦血流孔中测量血样混合物的DC阻抗,并获得血样混合物的血细胞分布;(C)区分有核红细胞与其他细胞类型;(d)在预先设定的波长下测定血样混合物的分光光度吸收值,所述波长为溶解后的血样形成的血红蛋白色原的波长;(e)报告有核红细胞的存在,及(f)报告血样中血红蛋白的浓度。如前述所述,该方法可进一步计数有核红细胞并报告每100个白细胞中有核红细胞的数量。
进一步地,该方法还包括以下步骤:通过DC阻抗法测得剩余血细胞的计数,并从剩余血细胞数目中减去有核红细胞,以及报告血样中白细胞的数目。
如上所述描述了非聚焦血流孔中使用DC阻抗法测量有核血细胞,并区分有核红细胞和其他细胞类型的方法。为同时测量血样中的血红蛋白浓度,溶解剂中含有一种血红蛋白配体,该配体在红细胞溶解后,形成稳定的血红蛋白色原。适合的配体包括四唑及其衍生物、咪唑及其衍生物、苯甲酸碱金属盐及其衍生物和喹哪啶酸。美国专利号5,763,280(授予Li等)中描述了这些配体,这里全部引入作为参考。适合的咪唑衍生物包括:甲基咪唑和乙基咪唑。可替换地,如前所述如果使用血液稀释剂稀释血样,还可在血液稀释剂中加入血红蛋白配体。此外,含有一种或多种盐的溶解剂也可以包含测量血红蛋白的血红蛋白配体,该溶解剂可在不另外使用血液稀释剂的情况下进行阻抗的测定。实施例4描述了一种这样的方法,该方法只用一种溶解剂而未另外使用血液稀释剂,对血样中的NRBCs进行鉴别并测量血样中的血红蛋白的浓度。
血样中的总血红蛋白浓度可以通过在预定的波长下测定血样混合物的分光光度吸收值而确定。不同的血红蛋白色原的波长不同。使用上述配体,可在约510nm和约560nm之间测定该吸收值。
实施例5描述了使用本发明的方法分析临床样品。使用试验血液分析仪(实施例1中详述了该仪器的结构)分析共95份正常血样和含有NRBCs的74份临床全血样,并使用以实施例5的溶解剂组合物,以IsotonIII作为稀释剂。同样的样品经过COULTER GEN*S血液分析仪和COULTERCOULTER ZBI的分析作为参考。使用NCCLS标准法对每500个细胞进行人工计数,所得的每100个WBC中的NRBC数目作为参考值。
试验血液分析仪中得到的DC分布图经过实验推导分析,将NRBCs从白细胞中鉴别出来,并报告每100个WBC中的NRBC数目。从总有核细胞数中减去NRBCs即得到校正的白细胞计数。
图5A表示NRBC计数的结果,该结果表明本发明的方法获得的结果和人工参考值有良好的线性关系。
图5B表示使用实施例所述的方法和COULTER GEN*S测得的血红蛋白浓度的关系。该结果表明这两种测量血红蛋白的方法之间有极好的线性关系。
图5C表示参考校正值与本发明的方法所得白细胞校正值之间的关系。参考结果为从COULTER COULTER ZBI测得的白细胞数中减去NRBC的人工计数所得的数值。如图所示,通过本发明的方法获得的结果与参考值之间有极好的相关性。
进一步地,本发明涉及鉴别血样中有核血细胞的装置。该装置包括(a)将血样与溶解剂体系混合以溶解红细胞并形成血细胞样品混合物的设备;(b)在非聚焦孔中测定血样混合物的DC阻抗,并获得血样混合物中血细胞的分布的设备;(c)通过获得的血细胞分布图,鉴别有核红细胞和其他细胞类型的设备。该非聚焦孔的长宽比优选为1.0或1.0以上。
以下实施例是对本发明示例性的说明,并非以任何方式限制本发明的范围,本发明的范围如权利要求所限定。如前所述,本发明亦可选用多种其他组分和不同比例。
实施例1
使用如下组分的试剂溶解血样,进行有核血细胞的分析。
溴化十四烷基三甲基铵 25.0g
Igepal SS-837(Rhne-Poulenc生产) 15.0g
Plurofac A38 prill表面活性剂(BASF公司生产) 4.0g
蒸馏水调至1升
PH 5.0
试验血液分析仪吸入28微升全血样,经6毫升IsotonIII(佛罗里达州,迈阿密,Beckman Coulter公司生产)稀释,并与1毫升上述溶解剂组合物混合以溶解红细胞。该样品混合物在持续真空装置的作用下,通过一组平行的三个非聚焦血流孔。该孔长120μ,宽100μ。有核血细胞通过DC阻抗测量法进行计数,并生成经过脉冲编辑处理后的血细胞分布图(为三孔测量的均值)。
图1A表示通过以上步骤获得的新鲜正常血的细胞分布图,其中白细胞呈双重模式分布。图1B和1C表示通过以上步骤测得的两份临床样品。所述临床样品分别含有230NRBC/100WBC和9NRBC/100WBC。如图所示,明显的NRBC群体出现在白细胞的左侧。该NRBC群体从白细胞中鉴别出来,NRBCs与白细胞(×100)的比例表示为NRBC数/100WBC。可替换地,通过考虑全部的白细胞数目后,也可按血样中的绝对值报告NRBC。
实施例2
图2A和2B分别表示正常血样和含有NRBCs的临床样品的分布图,该样品经过实施例1中描述的步骤处理,在具有单一非聚焦血流孔的试验血液分析仪上进行测量。孔长70μ,宽100μ。其长宽比为0.7。该试验血液分析仪与实施例1中使用的分析仪的信号放大比例不同。如图所示,NRBC群体出现在白细胞的左侧。
实施例3
图3A和3B是两张含有NRBCs的临床样品的分布图,该样品经过实施例1中所述步骤处理,并在两台试验血液分析仪上进行测量,除了其中一台分析仪的非聚焦血流孔长120μ,宽100μ,另一台的非聚焦血流孔长85,宽70μ外,两台试验血液分析仪使用的试剂和仪器结构均相同。图3A中所示的分布图是使用长120μ,宽100μ的非聚焦血流孔得到的。图3B中所示的分布图是使用长85μ,宽70μ的非聚焦血流孔得到的。尽管这两种类型的孔长和宽完全不同,其长宽比均为1.2。明显地,该两张分布图表示的细胞分布相似。在两种情况下,均可达到区分NRBC群体和其他有核细胞。
实施例4
制备如下组分的试剂。
溴化十四烷基三甲基铵 3.48g
Igepal SS-837(Rhne-Poulenc生产) 2.09g
Plurofac A38 prill表面活性剂(BASF公司生产) 0.56g
四唑 0.28g
Na2SO4 7.94g
NaCl 3.46g
Na2EDTA 0.09g
ADA 1.21g
抗菌素 0.98g
BHT(预先溶于乙醇) 0.01g
蒸馏水调至1升
pH 5.8
渗透压 312mOsm
使用试验血液分析仪对含有31NRBC/100WBC(人工参考方法测得)的临床全血样进行分析,该分析仪与实施例1所述的试验血液分析仪结构相同,但是上述溶解剂组合物同时作为溶解剂和稀释剂。
图4A代表获得的分布图,表明了将NRBC与白细胞区分开。
此外,11.6微升同一样品与2903微升上述溶解剂组合物稀释并混合。立即在Beckman DU 7500分光光度计中测量样品的光吸收谱。图4B是所得的吸收谱。如图所示,样品中的血红蛋白浓度可在约510nm和约560nm之间测出。
实施例5
制备如下组分的试剂。
溴化十四烷基三甲基铵 25.0g
Igepal SS-837(Rhne-Poulenc生产) 15.0g
Plurofac A38 prill表面活性剂(BASF公司生产) 4.0g
四唑 2.0g
BHT(预先溶于乙醇) 0.04g
蒸馏水调至1升
pH 2.9
在实施例1所述的试验血液分析仪上分析95份正常样品和含有NRBC的74份临床全血样,但是使用的孔长85μ,宽70μ。该分析仪使用上述溶解剂和IsotonIII稀释剂。计数有核血细胞后,立刻在分析仪上于525nm测定该样品混合物的吸收值。分析仪还报告样品的血红蛋白浓度。该样品也由COULTERGEN*S血液分析仪和COULTER COULTERZBI进行分析。在生产商说明书中的标准设置下操作COULTERGEN*S,以Lyse SIIIdiff(佛罗里达州,迈阿密,Beckman Coulter公司)作为溶解剂,IsotonIII作为稀释剂。血样中的白细胞计数按NCCLS参考步骤在COULTERCOULTER ZBI中进行。COULTER COULTER ZBI的阈值设置在7.5以保证有核红细胞的计数。三名医学检验员对所有的临床样品进行500个细胞的计数,并作为有核红细胞计数的参考值,结果按每100个白细胞计数中的有核红细胞数量表示(NRBC数/100WBC)。
分析实验推导得出的DC分布图以区分有核红细胞与白细胞,并报告每100个白细胞的有核红细胞数量。然后从总有核血细胞数量中减去有核红细胞的数量就得到校正的白细胞计数。
图5A表示相对于人工参考值,通过上述方法获得的有核红细胞计数的结果。其相关系数,斜率和回归线的截距表明,该有核红细胞具有良好的线性关系。
图5B表示试验血液分析仪和COULTERGEN*S血液分析仪所测得的血红蛋白浓度的结果间的关系。该结果表明血红蛋白浓度有极好的线性关系。
图5C表示采用上述方法在试验血液分析仪上得到校正的白细胞计数与从COULTER COULTERZBI测得的白细胞数目中减去人工计数的有核红细胞数目所得校正的白细胞计数之间的关系。结果表明本发明的方法与所述参考方法有极好的线性关系。
实施例6进一步说明了本发明的作用,即区分有核红细胞和白细胞以及进一步鉴别白细胞亚群如淋巴和髓样亚群。
实施例6
使用如下组分的试剂溶解血样并分析有核血细胞。
溴化十四烷基三甲基铵 35.0g
Igepal SS-837(Rhne-Poulenc生产) 12.8g
氯化钠 9.0g
氰化钾 0.25g
蒸馏水调至1升
pH 9.3
试验血液分析仪吸入28微升全血样,经6毫升Isoton3E(佛罗里达州,迈阿密,Beckman Coulter公司)稀释,并与1毫升上述的溶解剂组合物混合以溶解红细胞。该样品混合物在持续真空装置的作用下,通过一组平行的三个非聚焦血流孔。该孔长100,宽83μ。有核血细胞通过DC阻抗测量法进行计数,并生成经过脉冲编辑处理后的血细胞分布图(代表三孔测量的均值)。
图6表示通过以上步骤获得的含有4NRBC/100WBC的临床血样的分布图。如图所示,三种有核血细胞彼此区分开。更具体地,有核红细胞的峰位于白细胞峰的左侧。白细胞进一步分成两个亚群,淋巴(淋巴细胞)群体和髓样(中性粒细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞)群体。本实施例表明了本发明的方法在区分有核红细胞和白细胞以及进一步区分白细胞亚群中的用途。
Claims (29)
1.一种区分血样中有核红细胞和其他细胞类型的方法,该方法包括以下步骤:
(a)将血样与溶解剂混合以溶解红细胞并形成血样混合物;
(b)使用非聚焦血流孔测量所述血样混合物的DC阻抗,得到所述血样混合物的血细胞分布;
(c)根据获得的血细胞分布区分有核红细胞和其他细胞类型;以及
(d)报告所述血样中的有核红细胞。
2.如权利要求1所述的方法,其中所述的报告有核红细胞的步骤包括报告所述血样中有核红细胞的存在。
3.如权利要求1所述的方法,其中所述的报告有核红细胞的步骤包括报告相对于每100个白细胞的有核红细胞的数量。
4.如权利要求1所述的方法,其中所述的通过测量DC阻抗测定所述的血样混合物的步骤还包括计数所述血样混合物中的白细胞。
5.如权利要求4所述的方法,其中所述的报告有核红细胞的步骤包括报告所述血样单位体积中有核红细胞的数量。
6.如权利要求1所述的方法,其中所述非聚焦血流孔的长宽比为0.7或0.7以上。
7.如权利要求6所述的方法,其中所述非聚焦血流孔的长宽比为1.0或1.0以上。
8.如权利要求7所述的方法,其中所述非聚焦血流孔的长宽比约为1.2。
9.如权利要求1所述的方法,其中所述的将血样与溶解剂混合的步骤包括使用血液稀释剂稀释所述血样以形成稀释的血样,并混合所述的稀释血样与所述的溶解剂。
10.如权利要求1所述的方法,其中所述的将血样与溶解剂混合的步骤包括将所述的血样与含有盐的溶解剂混合以同时稀释并溶解所述血样。
11.如权利要求1所述的方法,该方法还包括在预先设定的波长下测定所述血样混合物的分光光度吸收值并报告所述血样的血红蛋白浓度,所述波长为溶解所述血样后形成的血红蛋白色原的波长。
12.如权利要求11所述的方法,其中所述的血样混合物的吸收值在约510nm和约560nm之间测定。
13.一种校正白细胞计数的方法,该方法包括以下步骤:
(a)将血样与溶解剂混合以溶解红细胞并形成血样混合物;
(b)使用非聚焦血流孔测量所述血样混合物的DC阻抗,得到血细胞分布以及剩余血细胞计数;
(c)从获得的血细胞分布将有核红细胞和其他干扰物质与白细胞区分开;
(d)从所述的剩余血细胞的计数中减去有核红细胞和其他干扰物质;
(e)报告所述血样的校正白细胞计数。
14.如权利要求13所述的方法,该方法还包括报告所述血样中有核红细胞的存在。
15.如权利要求13所述的方法,该方法还包括报告所述血样中有核红细胞的数量。
16.如权利要求13的方法,其中所述的非聚焦血流孔的长宽比为0.7或0.7以上。
17.如权利要求16所述的方法,其中所述的非聚焦血流孔的长宽比为1.0或1.0以上。
18.一种同时区分有核红细胞、计数白细胞并测量血样的血红蛋白浓度的方法,该方法包括以下步骤:
(a)将血样与溶解剂混合以溶解红细胞并形成血样混合物;
(b)使用非聚焦血流孔测量血样混合物的DC阻抗,得到血细胞分布以及剩余血细胞计数;
(c)从获得的血细胞分布中将有核红细胞和其他干扰物质与白细胞区分开;
(d)从所述的剩余血细胞计数中减去有核红细胞和其他干扰物质;
(e)在预先设定的波长下测定所述血样混合物的分光光度吸收值,该波长为溶解所述血样后形成的血红蛋白色原的波长;
(f)报告所述血样中有核红细胞;
(g)报告所述血样中白细胞的数目;并
(h)报告所述血样的血红蛋白浓度。
19.如权利要求18所述的方法,其中所述的非聚焦血流孔的长宽比为0.7或0.7以上。
20.如权利要求19所述的方法,其中所述的非聚焦血流孔的长宽比为1.0或1.0以上。
21.如权利要求18所述的方法,其中所述的将血样与溶解剂混合的步骤包括使用血液稀释剂稀释所述血样以形成稀释的血样,并混合所述稀释血样和所述溶解剂。
22.如权利要求18所述的方法,其中所述的将血样与溶解剂混合的步骤包括将所述血样与含有盐的溶解剂混合,以同时稀释并溶解所述的血样。
23.如权利要求18所述的方法,其中所述血样混合物的吸收值在约510nm和约560nm之间测定。
24.一种分析血样中有核血细胞的方法,该方法包括以下步骤:
(a)将血样与溶解剂混合以溶解红细胞并形成血样混合物;
(b)使用非聚焦血流孔测量所述血样混合物的DC阻抗,得到所述血样混合物的血细胞分布和更好的细胞类型分离,所述非聚焦血流孔的长宽比为1.2或1.2以上;
(c)使用步骤(b)中获得的血细胞分布区分有核血细胞;及
(d)报告所述血样中有核血细胞的亚群。
25.如权利要求24所述的方法,其中所述有核血细胞亚群包括有核红细胞和白细胞。
26.如权利要求24所述的方法,其中所述的有核血细胞亚群包括白细胞亚群。
27.如权利要求24所述的方法,其中所述的将血样与溶解剂混合的步骤包括使用血液稀释剂稀释所述血样以形成稀释的血样,并混合所述稀释血样和溶解剂。
28.如权利要求24所述的方法,其中所述的将血样与溶解剂混合的步骤包括将所述血样与含有盐的溶解剂混合,以同时稀释并溶解所述的血样。
29.如权利要求24所述的方法,该方法还包括在预先设定的波长下测定所述血样混合物的分光光度吸收值以及报告所述血样中血红蛋白的浓度,所述波长为溶解所述血样后形成的血红蛋白色原的波长。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US09/917,533 | 2001-07-27 | ||
| US09/917,533 US6410330B1 (en) | 2001-07-27 | 2001-07-27 | Method for measurement of nucleated red blood cells |
| US16569902A | 2002-06-07 | 2002-06-07 | |
| US10/165,699 | 2002-06-07 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1549925A CN1549925A (zh) | 2004-11-24 |
| CN1276252C true CN1276252C (zh) | 2006-09-20 |
Family
ID=26861630
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN02814528.3A Expired - Fee Related CN1276252C (zh) | 2001-07-27 | 2002-07-25 | 有核红细胞的测量方法 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US6673618B1 (zh) |
| EP (1) | EP1412740B1 (zh) |
| JP (1) | JP2005506525A (zh) |
| CN (1) | CN1276252C (zh) |
| WO (1) | WO2003012429A1 (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102713628A (zh) * | 2009-11-17 | 2012-10-03 | 雅培医护站股份有限公司 | 在竞争性免疫测定中减少白细胞干扰 |
Families Citing this family (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6509192B1 (en) * | 1992-02-24 | 2003-01-21 | Coulter International Corp. | Quality control method |
| US6916658B2 (en) * | 2001-07-27 | 2005-07-12 | Beckman Coulter, Inc. | Method for measurement of immature granulocytes |
| US8986944B2 (en) * | 2001-10-11 | 2015-03-24 | Aviva Biosciences Corporation | Methods and compositions for separating rare cells from fluid samples |
| US8980568B2 (en) | 2001-10-11 | 2015-03-17 | Aviva Biosciences Corporation | Methods and compositions for detecting non-hematopoietic cells from a blood sample |
| US7198953B2 (en) * | 2003-10-12 | 2007-04-03 | Beckman Coulter, Inc. | Method of using a reference control composition for measurement of nucleated red blood cells |
| US7195919B2 (en) * | 2003-12-19 | 2007-03-27 | Beckman Coulter, Inc. | Hematology controls for reticulocytes and nucleated red blood cells |
| EP1714146B1 (en) * | 2004-02-10 | 2022-08-03 | Beckman Coulter, Inc. | Method of measurement of nucleated red blood cells |
| US7135341B2 (en) * | 2004-04-07 | 2006-11-14 | Beckman Coulter, Inc. | Reference control containing a nucleated red blood cell component |
| US7482165B2 (en) | 2005-08-24 | 2009-01-27 | Beckman Coulter, Inc. | Method of preventing white blood cell interferences to red blood cell measurements of a blood sample |
| US7354767B2 (en) * | 2006-03-16 | 2008-04-08 | Beckman Coulter, Inc. | Reference control composition containing a nucleated red blood cell component made of non-nucleated blood cells |
| KR100833793B1 (ko) * | 2006-05-16 | 2008-05-29 | 세원셀론텍(주) | 골수 유래 골 생성용 유핵 세포 분리 방법 |
| CA2657621A1 (en) * | 2006-07-14 | 2008-01-17 | Aviva Biosciences Corporation | Methods and compositions for detecting rare cells from a biological sample |
| US7754487B2 (en) * | 2006-11-14 | 2010-07-13 | Beckman Coulter, Inc. | Hematology linearity control composition, system and method of use |
| CN101723874B (zh) * | 2008-10-31 | 2013-09-11 | 深圳迈瑞生物医疗电子股份有限公司 | 花菁类化合物及其在生物样品染色中的用途 |
| CN102282467B (zh) * | 2008-11-13 | 2014-08-13 | 贝克曼考尔特公司 | 对血红蛋白测量的颗粒干扰的校正的方法 |
| CN101750476B (zh) * | 2008-12-08 | 2015-06-03 | 深圳迈瑞生物医疗电子股份有限公司 | 血液分析试剂及其使用方法 |
| EP2216095A1 (en) * | 2009-01-27 | 2010-08-11 | Koninklijke Philips Electronics N.V. | Microfluidic device for full blood count |
| CN102109430B (zh) * | 2009-12-25 | 2013-11-06 | 深圳迈瑞生物医疗电子股份有限公司 | 有核红细胞模拟粒子,血液质控物及其制备方法和用途 |
| AU2011326516A1 (en) * | 2010-11-09 | 2013-05-02 | Daktari Diagnostics, Inc. | Counting particles using an electrical differential counter |
| ES2828660T3 (es) * | 2012-07-05 | 2021-05-27 | Beckman Coulter Inc | Método y aparato para determinar recuentos de leucocitos |
| JP6092132B2 (ja) * | 2014-01-29 | 2017-03-08 | シスメックス株式会社 | 血球分析装置 |
| CN106537144A (zh) * | 2014-08-05 | 2017-03-22 | 富士胶片株式会社 | 有核红血球的分选方法 |
| CN106687810B (zh) * | 2014-12-31 | 2019-10-22 | 深圳迈瑞生物医疗电子股份有限公司 | 一种非诊断目的的有核红细胞报警方法、装置及流式细胞分析仪 |
| CN107817208A (zh) * | 2016-09-12 | 2018-03-20 | 深圳市帝迈生物技术有限公司 | 一种血细胞计数装置及其白细胞计数修正方法 |
| WO2019206312A1 (zh) | 2018-04-28 | 2019-10-31 | 深圳迈瑞生物医疗电子股份有限公司 | 样本分析仪异常的报警方法、系统及存储介质 |
| CN111801568A (zh) * | 2018-04-28 | 2020-10-20 | 深圳迈瑞生物医疗电子股份有限公司 | 测定血小板浓度的方法及系统 |
Family Cites Families (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2656508A (en) | 1949-08-27 | 1953-10-20 | Wallace H Coulter | Means for counting particles suspended in a fluid |
| US3810011A (en) | 1970-05-25 | 1974-05-07 | Coulter Electronics | Apparatus and method for analyzing the particle volume distribution for a plurality of particles of different size in a quantity of liquid |
| KR970007077B1 (ko) * | 1987-03-13 | 1997-05-02 | 코울터 일렉트로닉스 인커퍼레이티드 | 광산란 기술을 이용한 다중-부분식별 분석 방법 |
| US5242832A (en) | 1990-03-01 | 1993-09-07 | Toa Medical Electronics Co., Ltd. | Reagent for measurement of leukocytes and hemoglobin in blood |
| JP2927979B2 (ja) | 1991-02-22 | 1999-07-28 | シスメックス株式会社 | フローサイトメトリーによる赤芽球の分類方法 |
| US5376878A (en) * | 1991-12-12 | 1994-12-27 | Fisher; Timothy C. | Multiple-aperture particle counting sizing and deformability-measuring apparatus |
| DE69434942T2 (de) * | 1993-02-25 | 2007-11-29 | Abbott Laboratories, Abbott Park | Mehrzweckreagenzsystem zur schnellen lysierung von vollblutproben |
| JP3523878B2 (ja) * | 1994-03-11 | 2004-04-26 | アボット・ラボラトリーズ | ヘモグロビンの定量用無シアン化物試薬及び方法 |
| US5559037A (en) * | 1994-12-15 | 1996-09-24 | Abbott Laboratories | Method for rapid and simultaneous analysis of nucleated red blood cells |
| US5879900A (en) * | 1994-12-15 | 1999-03-09 | Abbott Laboratories | Method for simultaneous analysis of cell viability, nucleated red blood cells and white blood cell differentials |
| US5882933A (en) * | 1995-06-08 | 1999-03-16 | Coulter International Corp. | Method for determination of leukocytes and hemoglobin concentration in blood |
| US5817518A (en) * | 1995-12-18 | 1998-10-06 | Coulter International Corp. | Reagent and method for differential determination of leukocytes in blood |
| US5882934A (en) | 1997-01-21 | 1999-03-16 | Coulter International Corp. | Composition and method for hemoglobin and cell analysis |
| US5763280A (en) | 1997-01-21 | 1998-06-09 | Coulter International Corp. | Cyanide-free lytic reagent composition and method for hemoglobin and cell analysis |
| US5917584A (en) | 1997-11-21 | 1999-06-29 | Coulter International Corp. | Method for differentiation of nucleated red blood cells |
| US5874310A (en) * | 1997-11-21 | 1999-02-23 | Coulter International Corp. | Method for differentiation of nucleated red blood cells |
| JP3886271B2 (ja) | 1998-11-27 | 2007-02-28 | シスメックス株式会社 | 赤芽球の分類計数用試薬及び分類計数方法 |
| US6228652B1 (en) * | 1999-02-16 | 2001-05-08 | Coulter International Corp. | Method and apparatus for analyzing cells in a whole blood sample |
| US6410330B1 (en) * | 2001-07-27 | 2002-06-25 | Coulter International Corp. | Method for measurement of nucleated red blood cells |
| US6472215B1 (en) * | 2001-07-27 | 2002-10-29 | Coulter International Corp. | Method of analyzing nucleated red blood cells in a blood sample |
| WO2012107919A1 (en) | 2011-02-12 | 2012-08-16 | Solarbead Ltd. | Systems and methods for photovoltaic micro-inverter power harvesting efficiency increase in shaded conditions |
-
2002
- 2002-07-25 JP JP2003517572A patent/JP2005506525A/ja active Pending
- 2002-07-25 EP EP02752578.1A patent/EP1412740B1/en not_active Expired - Fee Related
- 2002-07-25 CN CN02814528.3A patent/CN1276252C/zh not_active Expired - Fee Related
- 2002-07-25 WO PCT/US2002/023656 patent/WO2003012429A1/en active Application Filing
- 2002-08-23 US US10/226,800 patent/US6673618B1/en not_active Expired - Lifetime
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102713628A (zh) * | 2009-11-17 | 2012-10-03 | 雅培医护站股份有限公司 | 在竞争性免疫测定中减少白细胞干扰 |
| CN102713628B (zh) * | 2009-11-17 | 2014-12-10 | 雅培医护站股份有限公司 | 在竞争性免疫测定中减少白细胞干扰 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2005506525A (ja) | 2005-03-03 |
| US6673618B1 (en) | 2004-01-06 |
| WO2003012429A1 (en) | 2003-02-13 |
| EP1412740B1 (en) | 2015-07-08 |
| CN1549925A (zh) | 2004-11-24 |
| US20030235917A1 (en) | 2003-12-25 |
| EP1412740A4 (en) | 2005-12-28 |
| EP1412740A1 (en) | 2004-04-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1276252C (zh) | 有核红细胞的测量方法 | |
| US7208319B2 (en) | Method of measurement of nucleated red blood cells | |
| US7008792B2 (en) | Method of measurement of nucleated red blood cells | |
| JP4184258B2 (ja) | 光学式赤血球および白血球の弁別 | |
| JP4433611B2 (ja) | 有核の赤血球の識別方法 | |
| US6472215B1 (en) | Method of analyzing nucleated red blood cells in a blood sample | |
| US6410330B1 (en) | Method for measurement of nucleated red blood cells | |
| US9797824B2 (en) | Method for hematology analysis | |
| US20030219850A1 (en) | Method for automatically analyzing nucleated bone marrow cells | |
| JP2005506525A5 (zh) | ||
| CA2759392A1 (en) | Method for discriminating red blood cells from white blood cells by using forward scattering from a laser in an automated hematology analyzer | |
| JP2004537727A5 (zh) | ||
| JP4668929B2 (ja) | 未成熟顆粒球の計測方法 | |
| JP7291337B2 (ja) | 骨髄液分析方法、試料分析装置及びコンピュータプログラム | |
| JP2001524665A (ja) | 赤芽球の識別方法 | |
| US20100075369A1 (en) | Analyzing Reticulocytes |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20060920 Termination date: 20190725 |
|
| CF01 | Termination of patent right due to non-payment of annual fee |