CN1426423B - 螯合淀粉样蛋白β肽的人源化抗体 - Google Patents
螯合淀粉样蛋白β肽的人源化抗体 Download PDFInfo
- Publication number
- CN1426423B CN1426423B CN018084303A CN01808430A CN1426423B CN 1426423 B CN1426423 B CN 1426423B CN 018084303 A CN018084303 A CN 018084303A CN 01808430 A CN01808430 A CN 01808430A CN 1426423 B CN1426423 B CN 1426423B
- Authority
- CN
- China
- Prior art keywords
- ser
- antibody
- val
- gly
- leu
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/567—Framework region [FR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Abstract
描述了一种预防性以及治疗性治疗特征在于淀粉样斑形成的病症的方法。所述方法使用的人源化抗体螯合人体生物学液体中可溶性Aβ肽,或者优先特异性结合淀粉样蛋白β肽Aβ位置13-28包含的表位。
Description
相关申请的交叉参考
本申请要求对2000年2月24日申请的美国临时申请60/184,601、2000年12月8日申请的60/254,465和2000年12月8日申请的60/254,498的优先权,所述每项临时申请的内容都通过引用结合到本文中。
技术领域
本发明涉及结合Aβ肽氨基酸13到28之间的表位的人源化抗体,以及涉及预防和治疗与β淀粉样蛋白有关的病症,例如阿耳茨海默氏病、Down氏综合征和脑淀粉样血管病。更具体地说,本发明涉及使用人源化单克隆抗体螯合血浆、脑和脑脊髓液中的淀粉样蛋白β(Aβ)肽,以预防Aβ肽在脑和脑血管中的积累或逆转Aβ肽在脑和脑血管中的沉积,由此改善认知。
背景技术
多种导致认知缺陷、中风、脑出血和一般性精神衰弱(generalmental debilitation)的症状似乎与脑内包含淀粉样蛋白β肽(Aβ)的神经斑和脑血管斑有关。在这些病症中,有临床前和临床阿耳茨海默氏病、Down氏综合征以及临床前和临床脑淀粉样血管病(CAA)。淀粉样蛋白β肽形成所述淀粉样斑。这些肽在血液和脑脊髓液(CSF)中循环,通常为与脂蛋白复合的形式。循环形式的Aβ肽包含39-43个氨基酸(大多数40或42个氨基酸),通过对共同前体蛋白的切割而产生,所述共同前体蛋白即淀粉样前体蛋白,通常命名为APP。溶解性Aβ的某些形式本身有神经毒性,可能决定神经变性和/或认知下降的严重性(McLean,C.A.等,Ann.Neurol.(1999)46:860-866;Lambert,M.P.等,(1998)95:6448-6453;Naslund,J.,J.Am.Med.Assoc.(2000)283:1571)。
证据显示:Aβ能够在脑和血液之间来回转运(Ghersi-Egea,J-F.等,J.Neurochem.(1996)67:880-883;Zlokovic,B.V.等,Biochem.Biophys.Res.Comm.(1993)67:1034-1040;Shibata M等,J.Clin.Invest.(2000)106:1489-1499)。此外,斑内的Aβ与脑和血液中的溶解性Aβ形成平衡(Kawarabayashi T等,J.Neurosci.(2001)372-381)。
如PCT申请US00/35681和美国序号09/153,130所述,CSF中Aβ肽的总循环水平在正常个体和倾向于呈现阿耳茨海默氏病的个体中相似,这两份文献都通过引用结合到本文中。然而,在患有阿耳茨海默氏病的个体中,平均Aβ42水平要更低(Nitsch,R.M.等,Ann.Neurol.(1995)37:512-518)。已知Aβ42比Aβ40更易聚集,当发生聚集时,随后就出现不利后果,例如Aβ在淀粉样斑中沉积、Aβ转化成毒性溶解型、神经细胞损伤和行为障碍如痴呆(Golde,T.E.等,Biochem.Biophys.Acta.(2000)1502:172-187)。
在1999年6月10日公开的PCT公开号WO99/27944中,描述了诱导免疫应答以减少淀粉样蛋白沉积的方法。该说明书假设全长聚集Aβ肽可能是有用的免疫原。给予与绵羊抗小鼠IgG缀合的Aβ片段(氨基酸13-28)并不导致大脑皮质淀粉样蛋白量发生变化,并且在接受Aβ13-28片段缀合物注射的动物中,仅有九分之一显示Aβ40作用下的淋巴增殖。该申请还指出:可以使用特异性结合Aβ肽的抗体作为治疗剂。然而,这看起来是推测性的,因为支持数据反映涉及使用例如Aβ42主动免疫的方法。使用佐剂提供所述肽,并确定免疫形成的抗体滴度和Aβ肽及前体肽的水平。该出版物明显提示:为缓解阿耳茨海默氏病症状,必须减少Aβ斑,并且成功减少Aβ斑需要细胞介导的过程。
1999年11月25日公开的WO 99/60024涉及利用抗淀粉样蛋白抗体去除淀粉样蛋白的方法。然而根据陈述,该机制利用抗Aβ抗体结合预形成淀粉样沉积(即淀粉样斑)的能力,导致随后局部小神经胶质细胞清除局部斑。没有在体内证明该机制。该出版物进一步陈述:为有效对抗Aβ斑,抗AB抗体必需到达脑实质并穿过血脑屏障。
在2000年12月7日公开了几份涉及尝试控制淀粉样斑的PCT申请。WO 00/72880描述:在阿耳茨海默氏病的转基因鼠模型中,当用Aβ肽的N末端片段以及结合它们的抗体进行治疗时,在皮质和海马内的淀粉样斑显著减少,而用缀合绵羊抗鼠IgG的Aβ13-28片段进行治疗或用对抗所述13-28片段的抗体即抗体266进行治疗时,则没有这种情况。人们断言所述N末端定向抗体在体外研究中穿过血脑屏障,并诱导对淀粉样斑的吞噬作用。
WO 00/72876公开内容事实上与WO 00/72880相同,涉及用淀粉样蛋白原纤维成分本身进行免疫。
WO 00/77178描述设计用于催化β-淀粉样蛋白水解的抗体,包括针对苯丙氨酸statine转换化合物Cys-Aβ10-25、statine Phe19-Phe20和Cys-Aβ10-25statine Phe20-Ala21的混合物产生的抗体,以及针对在Phe19和Phe20之间具有还原性酰胺键的Aβ10-25产生的抗体。该文件提到螯合Aβ,但这是猜测,因为它没有给出这种螯合的证据。此外,该文件没有提供体内证据证明给予抗体导致Aβ从中枢神经系统流出、干扰斑形成、减少淀粉样斑负荷、在所述抗体和组织样品中的Aβ之间形成复合物、或影响认知。
已经显示Aβ代谢的一条途径是从CNS转运到血浆(Zlokovic,B.V.等,Proc.Natl.Acad.Sci(USA)(1996)93:4229-4234;Ghersi-Egea,J-F.等,J.Neurochem.(1996)67:880-883)。此外,已经显示血浆中的Aβ能够穿过血脑屏障并进入脑内(Zlokovic,B.V.等,Biochem.Biophys.Res.Comm.(1993)67:1034-1040)。已经显示:在阿耳茨海默氏病的APPV717F转基因小鼠模型中,给予某些多克隆和单克隆Aβ抗体降低淀粉样斑内的Aβ沉积(Bard,F.等,Nature Med.(2000)6:916-919);然而,据说这是由于某些抗Aβ抗体穿过血脑屏障,刺激小胶质细胞吞噬淀粉样斑。在Bard的试验中,对来自体内的脑切片的测定显示:加入的Aβ抗体与外源加入的小胶质细胞一起诱导对Aβ的吞噬,导致除去Aβ沉积。
使用标准化测试可以容易地检测CSF和血液中溶解性Aβ40和Aβ42的水平,所述标准化测试使用针对Aβ链上表位的抗体。在例如美国专利5,766,846、美国专利5,837,672和美国专利5,593,846中已经详细报道了所述测定。这些专利描述产生针对Aβ肽中心域的鼠单克隆抗体,据报道这些抗体在位置16和17周围、包括位置16和17上具有表位。还描述了针对N-末端区的抗体。据称几种单克隆抗体与Aβ肽的位置13-28发生免疫反应;它们不结合代表位置17-28的肽,因此根据所引用的专利,这证明包括位置16-17(α-分泌酶位点)在内的该区是这些抗体的靶。在已知结合Aβ氨基酸13到28的抗体中包括小鼠抗体266、4G8和1C2。
我们目前意外地发现:对24月龄半合子转基因小鼠(APPV717F)给予266抗体非常快速并且几乎完全地恢复认知(目标记忆(objectmemory))。然而,所述抗体并不具有本领域教导的有效治疗下列疾病和病症的抗体所需的特性:阿耳茨海默氏病、Down氏综合征和其它涉及Aβ肽的病症。更令我们惊奇的是,我们观察到结合Aβ位置13到28之间的抗体(266和4G8)能够螯合血液中结合的循环形式Aβ肽中的溶解型Aβ,并且外周给予抗体266导致相当大量的Aβ肽从CNS快速流出到血浆。这导致溶解性Aβ的清除增加,防止斑淀粉样形成,最惊人的是改善认知,甚至不一定降低Aβ淀粉样斑负荷、穿过血脑屏障达到任何显著的程度、修饰斑、激活细胞机制或以强亲和力与聚集的Aβ结合。
本发明的公开
本发明提供人源化抗体或其片段,所述抗体或其片段积极地影响涉及Aβ的疾病和病症中的认知,所述疾病和病症如临床或临床前阿耳茨海默氏病、Down氏综合征以及临床或临床前脑淀粉样血管病。所述抗体或其片段不必穿过血脑屏障、修饰淀粉样斑、激活细胞反应或甚至不必降低淀粉样斑负荷。另一方面,本发明提供提供人源化抗体及其片段,所述抗体或其片段螯合血液中结合的循环形式Aβ肽中的Aβ肽,改变溶解型Aβ和结合型Aβ在中枢神经系统和血浆中的清除。又一方面,本发明提供人源化抗体及其片段,其中所述人源化抗体特异性结合Aβ氨基酸13到28之间的表位。再一方面,本发明提供人源化抗体及其片段,其中CDR源自小鼠单克隆抗体266,并且其中所述抗体大致保留所述小鼠抗体的结合特性,具有与所述小鼠抗体在功能上等同的体外和体内特性(序列SEQ ID NO:1到SEQ ID NO:6)。另一方面,本发明提供人源化抗体及其片段,其中所述可变区具有包括以下的序列:来自小鼠抗体266的CDR和特异性人构架序列(序列SEQ ID NO:7-SEQ ID NO:10),其中所述抗体大致保留所述小鼠抗体的结合特性,具有与所述小鼠抗体266在功能上等同的体外和体内特性。再一方面,本发明提供人源化抗体及其片段,其中轻链是SEQ ID NO:11,重链是SEQ ID NO:12。
本发明的另一部分是编码上文所公开的人源化抗体或其片段的多核苷酸序列、包含编码所述人源化抗体或其片段的多核苷酸序列的载体、用所述载体转化的宿主细胞或掺入表达所述人源化抗体或其片段的多核苷酸的宿主细胞、本文所公开的人源化抗体及其片段的药用制剂、以及制造和使用上述物质的方法。
所述人源化抗体及其片段可用于螯合人体内的Aβ;用于治疗和预防特征在于脑内有Aβ斑或Aβ毒性的疾病和病症,例如人类阿耳茨海默氏病、Down氏综合征和脑淀粉样血管病;用于诊断人体内的这些疾病;以及用于确认人体是否会对使用针对Aβ的人类抗体的治疗有反应。
体内给予合适的人源化抗体以螯合在生物学液体中循环的Aβ肽可用于预防性治疗以及治疗性治疗涉及脑内形成包含Aβ的弥散斑(diffuse plaque)、神经斑和脑血管斑的病症。所述人源化抗体(包括其免疫反应性片段)导致从大分子复合物中去除Aβ肽,所述大分子复合物在正常情况下涉及在体液和形成斑的位点或所述Aβ肽有毒性的位点之间转运所述Aβ肽。此外,用所述抗体或其片段螯合血浆Aβ肽的作用象是一个“接受器(sink)”,有效螯合血浆区室中的溶解性Aβ肽,并诱导Aβ从中枢神经系统(CNS)的各位置进入血浆。通过螯合血液中的Aβ,增强从脑的净流出,防止溶解性Aβ沉积在不溶性斑内,并防止溶解性Aβ在脑内形成有毒性的溶解性种类。此外,斑内的不溶性Aβ与溶解性Aβ形成平衡,通过血液中的螯合效应,可以从脑内除去斑内不溶性Aβ。用所述抗体螯合Aβ肽也增强从体内去除所述Aβ肽,抑制溶解性Aβ在脑内的毒性效应,并抑制不溶性Aβ发展并进一步积累成为斑内的淀粉样蛋白。用于本发明的抗体并不大量穿过血脑屏障(≤0.1%血浆水平)。此外,当外周给予用于本发明的人源化抗体时,所述抗体不必在结合Aβ肽后或自由循环时在脑内引发细胞免疫应答以发挥它们的有益作用。此外,当外周给予时,所述抗体不必可观地结合脑内聚集的Aβ肽以发挥它们的有益作用。
因此,一方面,本发明涉及治疗和预防特征在于在人体内形成包含β-淀粉样蛋白的斑的病症,该方法包括给予(最好是外周给予)需要所述治疗的人治疗有效量或预防有效量的人源化单克隆抗体或其免疫反应性片段,所述抗体特异性结合Aβ肽的中心区。又一方面,本发明涉及抑制人体内淀粉样斑形成和清除人体内淀粉样斑的方法,所述方法包括给予需要所述抑制作用的人类个体有效量的人源化抗体,所述抗体螯合其血液循环形式中的Aβ肽,诱导Aβ肽流出脑,并改变血浆和脑中的Aβ清除。再一方面,本发明涉及所述人源化抗体(包括其免疫有效部分)以及制备它们的方法。
本发明还包括对诊断患有临床或临床前阿耳茨海默氏病、Down氏综合征或临床或临床前脑淀粉样血管病的患者逆转认知下降、改善认知、治疗认知下降和预防认知下降的方法,所述方法包括给予所述个体有效量本发明的人源化抗体。
本发明还包括使用本发明的人源化抗体生产药物,包括延长所述抗体或抗体片段的重组序列在人体组织内的表达,以治疗、预防或逆转阿耳茨海默氏病、Down氏综合征或大脑血管淀粉样样变性;以治疗、预防或逆转临床或临床前阿耳茨海默氏病、Down氏综合征或临床或临床前大脑血管淀粉样样变性的认知下降;或抑制淀粉样斑的形成或抑制毒性溶解性Aβ在人体内的效应。
本发明涉及惊人的观察结果:在给予本发明抗体后短时间内,相当大量的Aβ从中枢神经系统流出到血液。因此,本发明包括评价方法,评价人类个体对于用结合Aβ或其片段的抗体治疗的反应,该方法包括:a)给予所述个体所述抗体或其片段;然后b)测量Aβ在所述个体血液中的浓度。
本发明还包括用结合Aβ或其片段的抗体治疗人类个体的方法,该方法包括:a)给予所述个体首次量的所述抗体或其片段;b)给予第一次剂量后3小时到2周内,测量Aβ在所述个体体内的浓度;c)如果需要,根据步骤b)的结果计算抗体或其片段第二次的量,其中第二次的量与第一次的量相同或不同;然后d)给予第二次剂量的所述抗体或其片段。
本发明还包括评价方法,评价在人类个体中抗体结合Aβ或其片段以抑制或预防Aβ淀粉样斑形成、减少Aβ淀粉样斑、降低毒性溶解性Aβ的作用或治疗与Aβ斑有关的病症或疾病的效能,该方法包括:a)获取所述个体血浆或CSF的第一份样品;b)测量第一份样品中Aβ的基线浓度;c)给予所述个体所述抗体或其片段;d)给予所述抗体或其片段后3小时到2周,获取所述个体血浆或CSF的第二份样品;然后e)测量第二份样品中Aβ的浓度;其中,效能与血液中结合所述抗体的Aβ的量以及CSF中Aβ的浓度有关。
附图简述
图1显示通过Mab 266用透析膜从人脑脊髓液回收Aβ肽的百分率与透析膜截止分子量的函数。
图2显示在注射200μg或600μg Mab 266后APPV717F转基因小鼠血浆内存在的AβTotal浓度与时间的函数。
图3A显示在用盐水、小鼠IgG或Mab 266治疗的APPV717F转基因小鼠皮质内Aβ肽沉积的量。图3B显示这些结果与亲代来源的相关性。
图4显示用于从质粒pVk-Hu266表达人源化266轻链的多核苷酸序列以及所表达的人源化266轻链的单氨基酸编码(成熟时对应于SEQ ID NO:11)。
图5显示用于从质粒pVg1-Hu266表达人源化266重链的多核苷酸序列和所表达的人源化266重链的单氨基酸编码(成熟时对应于SEQ ID NO:12)。
图6是pVk-Hu266的质粒图。
图7是pVg1-Hu266的质粒图。
发明实施方式
在人类生物学液体内循环的Aβ肽代表染色体21编码的前体蛋白的羧基末端区。根据体外实验的结果,已经报道Aβ肽在生理溶液内溶解度很小,因为它包含一段疏水氨基酸,该段氨基酸构成将其更长的前体锚定到细胞脂质膜的区段的一部分。因此,并不奇怪循环Aβ肽通常与其它部分结合,防止其聚集。这导致难以检测生物学液体中循环Aβ肽。
上面提到的专利文件(美国专利5,766,846、美国专利5,837,672和美国专利5,593,846)描述抗体制备,包括单克隆抗体,由于所述抗体针对克隆266,因此将其命名为克隆266,已经显示该抗体特异性结合包含Aβ肽氨基酸13-28的肽。本发明申请人已经发现:结合该区的抗体与结合Aβ氨基酸序列中其它位点的抗体不同,能够非常有效地从大分子复合物中螯合溶解性Aβ肽。该螯合将实现Aβ肽从CNS的净流出,改变其在CNS和血浆中的清除,降低其用于形成斑的有效性。因此,具有该特异性的抗体提供预防性治疗和治疗性治疗与形成β-淀粉样蛋白斑有关的病症的机会,其中将所述抗体转化为人源化形式以降低它们的免疫原性。如上文提到的,这些病症包括临床前和临床阿耳茨海默氏病、Down氏综合征以及临床前和临床脑淀粉样血管病。
本文所用的术语“治疗”包括治疗性治疗(已知存在需要治疗的病症)、预防(即防止)或改善未来可能发生的病症。
“结合Aβ肽中区的单克隆抗体”指结合氨基酸序列的单克隆抗体(Mab或Mabs),所述氨基酸序列代表Aβ位置13到28之间所包含的表位。不一定针对整个区。只要所述抗体结合该区内的至少一个表位(例如,尤其是包括α分泌酶位点16-17或抗体266结合的位点),所述抗体就可以有效用于本发明的方法。
“抗体”本质上指单克隆抗体或其免疫有效片段,例如其Fab、Fab′或F(ab′)2片段。在本文的一些地方,将特别强调片段;然而,应当知道不论是否特定指出是片段,术语“抗体”包括这样的片段以及单链形式。只要所述蛋白保持特异性结合其既定靶且在这种情况下从血液中Aβ肽的载体蛋白中螯合Aβ肽的能力,它就在术语“抗体”的范围内。定义“抗体”还包括,例如,具有该特异性的抗体的单链形式,该形式一般情况下名为FV区。用于本发明的抗体最好但不一定是重组产生,因为需要操作具有合适特异性的抗体,所述抗体一般情况下是小鼠抗体或其它非人类抗体,将它们转化为人源化形式。抗体可以是糖基化的或未糖基化的,而优选糖基化抗体。众所周知,抗体通过二硫键适当交联。
已知基本抗体结构单位包含四聚体。每个四聚体由两对相同的多肽链组成,每对链包含一条“轻”链(约25kDa)和一条“重”链(约50-70kDa)。每条链的氨基末端部分包括一个约100到110个氨基酸或更长的可变区,该可变区负责抗原识别。每条链的羧基末端部分定义一个恒定区,该区主要负责效应子功能。
轻链分为γ、μ、α和λ。重链分为γ、μ、α、δ或ε,分别将抗体同种型定义为IgG、IgM、IgA、IgD和IgE。在轻链和重链内,可变区和恒定区通过一个约12个氨基酸或更长的“J”区连接,重链还包括一个约10多个氨基酸长的“D”区。
每个轻链/重链对的可变区形成抗体结合位点。因此,完整的抗体具有两个结合位点。所有链都呈现同样的通用结构,其中三个高变区连接相对保守的构架区(FR),所述通用结构也称为互补决定区或CDR。所述构架区使来自每一对两条链的CDR平行排列,使其能够结合特异性表位。从N末端到C末端,轻链和重链都包含结构域FR1、CDR1、FR2、CDR2、FR3、CDR3和FR4。按照众所周知的惯例划分每个域的氨基酸[Kabat“具有免疫价值的蛋白质序列”NationalInstitutes of Health,Bethesda,Md.,1987和1991;Chothia等,J.Mol.Biol.,196:901-917(1987);Chothia等,Nature 342:878-883(1989)]。
本领域内众所周知,通过标准技术可以容易地产生具有合适特异性的单克隆抗体:接种哺乳动物,从所述哺乳动物的抗体生成细胞形成杂交瘤,或用其它方法使所述细胞无限增殖化,然后培养所述杂交瘤或无限增殖化细胞,评价它们的合适特异性。在本发明的情况下,可以如下产生所述抗体:例如,用代表一个表位的肽免疫人、兔、大鼠或小鼠,所述表位包括Aβ肽的13-28区或其合适亚区。从产生所需抗体的杂交瘤或其它细胞回收所述核苷酸序列,获得用于重组操作的材料。然后操作这些核苷酸序列,以人源化形式提供它们。
“人源化抗体”指这样的抗体:通过改变具有非人类互补决定区(CDR)的抗体的序列,使所述抗体部分或全部由来自人抗体种系的氨基酸序列组成。最简单的所述改变包括仅仅用人抗体的恒定区取代小鼠恒定区,产生人/小鼠嵌合体,该嵌合体具有药物应用可接受的足够低的免疫原性。然而,最好也用目前本领域内众所周知的技术人源化所述抗体的可变区甚至CDR。用对应的人构架区取代所述可变区的构架区,保持所述非人类CDR基本完整,或甚至用来自人类基因组的序列取代所述CDR。在遗传改造小鼠体内产生完全的人抗体,其中已经改变所述小鼠的免疫系统使其对应于人免疫系统。如上文所提到的,使用所述抗体的免疫特异性片段、包括代表单链形式的片段足以应用于本发明方法。
人源化抗体还指这样的抗体:所述抗体包含人类构架区、至少一个来自非人类抗体的CDR,其中存在的任何恒定区与人免疫球蛋白恒定区基本相同,即至少约85-90%相同,优选至少95%相同。因此,人源化抗体的所有部分,可能除CDR外,都与一种或多种天然人免疫球蛋白序列的对应部分基本相同。例如,人源化免疫球蛋白一般不包括嵌合型小鼠可变区/人恒定区抗体。
当用于人类治疗时,人源化抗体与非人类和嵌合抗体相比至少有三个潜在的优势:
1)因为效应部分来自人类,因此它可以与人类免疫系统的其它部分更好地相互作用(如通过依赖补体的细胞毒性(CDC)或依赖抗体的细胞毒性(ADCC)更有效地破坏靶细胞)。
2)人类免疫系统不会将所述人源化抗体的构架区或C区识别为外源成分,因此针对所述注射抗体的抗体应答应该比针对完全外源的非人类抗体或部分外源的嵌合抗体的抗体应答更小。
3)已经报道注射非人类抗体在人体循环中的半寿期比人抗体的半寿期短得多。注射人源化抗体将具有与天然存在的人抗体基本相同的半寿期,使得可以使用更少和更低频率的剂量。
可以如下设计人源化免疫球蛋白。当氨基酸属于下面类别时,用来自提供CDR的非人类免疫球蛋白(供体免疫球蛋白)的构架氨基酸取代需要使用的人免疫球蛋白(接受者免疫球蛋白)的构架氨基酸:
(a)所述接受者免疫球蛋白人构架区内的氨基酸在该位置对于人免疫球蛋白是不常见的,而所述供体免疫球蛋白中的对应氨基酸在该位置对于人免疫球蛋白是常见的;
(b)所述氨基酸的位置紧接其中一个CDR;或
(c)在三维免疫球蛋白模型中,构架氨基酸中的任何侧链原子与CDR氨基酸任一原子的距离在约5-6埃之内(中心到中心)[Queen等,同前,和Co等,Proc.Natl.Acad.Sci.USA 88,2869(1991)]。当所述接受者免疫球蛋白人构架区内的每一个氨基酸以及所述供体免疫球蛋白内的对应氨基酸在该位置对于人免疫球蛋白是不常见的,那么就用在该位置对于人免疫球蛋白是常见的氨基酸取代所述氨基酸。
优选的人源化抗体是小鼠抗体266的人源化形式。人源化266的CDR具有如下氨基酸序列:
轻链CDR1:
1 5 10 15
Arg Ser Ser Gln Ser Leu Ile Tyr Ser Asp Gly Asn Ala Tyr Leu His(SEQ ID NO:1)
轻链CDR2:
1 5
Lys Val Ser Asn Arg Phe Ser(SEQ ID NO:2)
轻链CDR3:
1 5
Ser Gln Ser Thr His Val Pro Trp Thr(SEQ ID NO:3)
重链CDR1:
1 5
Arg Tyr Ser Met Ser(SEQ ID NO:4)
重链CDR2:
1 5 10 15
Gln Ile Asn Ser Val Gly Asn Ser Thr Tyr Tyr Pro Asp Thr Val Lys Gly(SEQID NO:5)
和重链CDR3:
1
Gly Asp Tyr(SEQ ID NO:6)
本发明人源化抗体的优选轻链可变区具有如下氨基酸序列,其中所述构架来自人种系Vk区段DPK18和J区段Jk1,并且在同一人V亚组的共有氨基酸发生几个氨基酸取代以减少潜在的免疫原性:
1 5 10 15
Asp Xaa Val Met Thr Gln Xaa Pro Leu Ser Leu Pro Val Xaa Xaa
20 25 30
Gly Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Xaa
35 40 45
Tyr Ser Asp Gly Asn Ala TyrLeu His Trp Phe Leu Gln Lys Pro
50 55 60
Gly Gln Ser Pro Xaa Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe
65 70 75
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
80 85 90
Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Xaa Gly Val
95 100 105
Tyr Tyr Cys Ser Gln Ser Thr His Val Pro Trp Thr Phe Gly Xaa
110
Gly Thr Xaa Xaa Glu Ile Lys Arg(SEQ ID NO:7)
其中:
在位置2的Xaa是Val或Ile;
在位置7的Xaa是Ser或Thr;
在位置14的Xaa是Thr或Ser;
在位置15的Xaa是Leu或Pro;
在位置30的Xaa是Ile或Val;
在位置50的Xaa是Arg、Gln或Lys;
在位置88的Xaa是Val或Leu;
在位置105的Xaa是Gln或Gly;
在位置108的Xaa是Lys或Arg;和
在位置109的Xaa是Val或Leu。
本发明人源化抗体的优选重链可变区具有如下氨基酸序列,其中所述构架来自人种系VH区段DP53和J区段JH4,并且在同一人亚组的共有氨基酸发生几个氨基酸取代以减少潜在的免疫原性:
1 5 10 15
Xaa Val Gln Leu Val Glu Xaa Gly Gly Gly Leu Val Gln Pro Gly
20 25 30
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
35 40 45
Arg Tyr Ser Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Xaa Leu Val Ala Gln Ile Asn Ser Val Gly Asn Ser Thr Tyr Tyr
65 70 75
Pro Asp Xaa Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Xaa
80 85 90
Xaa Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Xaa Asp
95 100 105
Thr Ala Val Tyr Tyr Cys Ala Ser Gly Asp Tyr Trp Gly Gln Gly
110
Thr Xaa Val Thr Val Ser Ser(SEQ ID NO:8)
其中:
在位置1的Xaa是Glu或Gln;
在位置7的Xaa是Ser或Leu;
在位置46的Xaa是Glu、Val、Asp或Ser;
在位置63的Xaa是Thr或Ser;
在位置75的Xaa是Ala、Ser、Val或Thr;
在位置76的Xaa是Lys或Arg;
在位置89的Xaa是Glu或Asp;和
在位置107的Xaa是Leu或Thr。
本发明人源化抗体尤其优选的轻链可变区具有如下氨基酸序列,其中所述构架来自人种系Vk区段DPK18和J区段JK1,并且在同一人V亚组的共有氨基酸发生几个氨基酸取代以减少潜在的免疫原性:
1 5 10 15
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu
20 25 30
Gly Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Ile
35 40 45
Tyr Ser Asp Gly Asn Ala Tyr Leu His Trp Phe Leu Gln Lys Pro
50 55 60
Gly Gln Ser Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe
65 70 75
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
80 85 90
Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
95 100 105
Tyr Tyr Cys Ser Gln Ser Thr His Val Pro Trp Thr Phe Gly Gln
110
Gly Thr Lys Val Glu Ile Lys Arg(SEQ ID NO:9)
本发明人源化抗体特别优选的重链可变区具有如下氨基酸序列,其中所述构架来自人种系VH区段DP53和J区段JH4:
1 5 10 15
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
20 25 30
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
35 40 45
Arg Tyr Ser Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Leu Val Ala Gln Ile Asn Ser Val Gly Asn Ser Thr Tyr Tyr
65 70 75
Pro Asp Thr Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
80 85 90
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp
95 100 105
Thr Ala Val Tyr Tyr Cys Ala Ser Gly Asp Tyr Trp Gly Gln Gly
110
Thr Leu Val Thr Val Ser Ser(SEQ ID NO:10)
本发明人源化抗体优选的轻链具有如下氨基酸序列:
1 5 10 15
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu
20 25 30
Gly Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Ile
35 40 45
Tyr Ser Asp Gly Asn Ala Tyr Leu His Trp Phe Leu Gln Lys Pro
50 55 60
Gly Gln Ser Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe
65 70 75
Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
80 85 90
Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
95 100 105
Tyr Tyr Cys Ser Gln Ser Thr His Val Pro Trp Thr Phe Gly Gln
110 115 120
Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val
125 130 135
Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala
140 145 150
Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
155 160 165
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
170 175 180
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
185 190 195
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
200 205 210
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
215
Thr Lys Ser Phe Asn Arg Gly Glu Cys(SEQ ID NO:11}
本发明人源化抗体优选的重链具有如下氨基酸序列:
1 5 10 15
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
20 25 30
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
35 40 45
Arg Tyr Ser Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Leu Val Ala Gln Ile Asn Ser Val Gly Asn Ser Thr Tyr Tyr
65 70 75
Pro Asp Thr Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
80 85 90
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp
95 100 105
Thr Ala Val Tyr Tyr Cys Ala Ser Gly Asp Tyr Trp Gly Gln Gly
110 115 120
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
125 130 135
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
140 145 150
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
155 160 165
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
170 175 180
Pro Ala Va1 Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
185 190 195
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
200 205 210
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
215 220 225
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
230 235 240
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
245 250 255
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
260 265 270
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
275 280 285
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
290 295 300
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val VAl Ser Val
305 310 315
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
320 325 330
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
335 340 345
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
350 355 360
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
365 370 375
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
380 385 390
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
395 400 405
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
410 415 420
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
425 430 435
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
440
Leu Ser Leu Ser Pro Gly Lys(SEQ ID NO:12)
还有其它可能可以作为本发明人源化抗体和人源化266的轻链和重链的序列。所述免疫球蛋白具有两对轻链/重链复合物,至少一条链包含与人构架区段功能性连接的一个或多个互补决定区。
另一方面,本发明涉及编码抗体的重组多核苷酸,当所述抗体得到表达时,其包含本发明抗体的重链和轻链CDR。至于人构架区,将提供CDR的非人类免疫球蛋白构架区或可变区氨基酸序列与人免疫球蛋白可变区序列集合中的对应序列相比较,选择相同氨基酸百分率高的序列。图4和图5给出代表性多核苷酸,当所述多核苷酸表达时编码包含单克隆抗体266重链和轻链CDR的多肽链。由于密码子简并性和非关键氨基酸取代,可以使用其它多核苷酸序列容易地取代那些序列。本发明尤其优选的多核苷酸编码抗体,当所述抗体得到表达时,其包含SEQ ID NO:1-SEQ ID NO:6的CDR、或SEQID NO:7-SEQ ID NO:10的任何可变区、或SEQ ID NO:11和SEQ IDNO:12的轻链和重链。
所述多核苷酸一般还包括有效连接人源化免疫球蛋白编码序列的表达控制多核苷酸序列,包括天然连接或异源的启动子区。所述表达控制序列最好是处于能够转化或转染真核宿主细胞的载体中的真核启动子系统,但也可以使用针对原核宿主的控制序列。一旦将所述载体掺入合适的宿主细胞系,就在适于高水平表达所述核苷酸序列的条件下培养所述宿主细胞,然后根据需要收集和纯化轻链、重链、轻链/重链二聚体或完整抗体、结合片段或其它免疫球蛋白形式。
可以从多种不同多核苷酸(基因组或cDNA、RNA、合成寡核苷酸等等)和成分(如V、J、D和C区),并通过多种不同技术形成能够最终表达所需人源化抗体的本发明核苷酸序列。连接合适的基因组序列和合成序列是生产的通用方法,但也可以利用cDNA序列。
可以按照众所周知的程序,从多种人类细胞(优选无限增殖化的B细胞)分离人恒定区DNA序列。相似地,可以从能够结合Aβ肽氨基酸13到28之间表位的非人类单克隆抗体获得用于生产本发明免疫球蛋白的CDR,所述单克隆抗体如上文所述,通过众所周知的方法在任何方便的哺乳动物来源中生产,包括小鼠、大鼠、兔或能够产生抗体的其它脊椎动物。可以从本领域内众所周知的多种来源获取适合所述多核苷酸序列的来源细胞以及用于表达和分泌免疫球蛋白的宿主细胞。
除本文专门描述的人源化免疫球蛋白外,利用本领域内技术人员众所周知的各种重组DNA技术可以容易地设计和生产其它“基本同源”的修饰免疫球蛋白。例如,所述构架区可能因为几个氨基酸取代、末端和中间添加和缺失等等,在一级结构水平上与天然序列有所不同。此外,可以单独使用或组合使用多种不同的人构架区作为本发明人源化免疫球蛋白的基础。一般地说,通过各种众所周知的技术可以容易地进行基因修饰,所述技术例如定点诱变。
或者,可以产生仅包含部分一级抗体结构的多肽片段,所述片段具有一种或多种免疫球蛋白活性(如补体结合活性)。如下产生这些多肽片段:通过本领域内众所周知的方法蛋白水解切割完整的抗体,或使用定点诱变在载体中所需位点插入终止密码子,如在CH1后插入以产生Fab片段或在铰链区后插入以产生F(ab′)2片段。通过用DNA接头连接VL和VH,可以产生单链抗体。
如以前所述,当将所述序列有效连接表达控制序列(即定位以保证表达控制序列发挥作用)后,在宿主中表达所述编码核苷酸序列。这些表达载体一般在宿主生物中或者作为附加体、或者作为宿主染色体DNA的整合部分复制。表达载体一般包含选择标记(如四环素或新霉素),以便可以检测出那些受到所需DNA序列转化的细胞。
大肠杆菌(E.coli)是尤其适用于克隆本发明多核苷酸的原核宿主。适用的其它微生物宿主包括杆菌,如枯草芽孢杆菌(Bacillussubtilus),以及其它肠杆菌科,如沙门氏菌属、沙雷菌属(Serratia)和各种假单胞菌属菌。也可以制造在这些原核宿主中的表达载体,所述表达载体一般将包含适合所述宿主细胞的表达控制序列(如复制原点)。此外,可以利用多种众所周知的启动子中的任何一种,例如乳糖启动子系统、色氨酸(trp)启动子系统、β-内酰胺酶启动子系统或来自λ噬菌体的启动子系统。所述启动子一般控制表达,可选地与操纵基因一起控制表达,并且具有核糖体结合位点序列等等,以起始和完成转录和翻译。
其它微生物如酵母也可用于表达。酵母属是优选宿主,根据需要,合适的载体具有表达控制序列,如启动子(包括3-磷酸甘油酸激酶或其它糖酵解酶)和复制原点、终止序列等等(根据需要)。
除微生物外,也可使用哺乳动物组织细胞培养物表达和产生本发明的多肽。事实上优选真核细胞,因为本领域已经发展出多种能够分泌完整免疫球蛋白的合适宿主细胞系,包括CHO细胞系、各种COS细胞系、金黄仓鼠卵巢细胞系、HeLa细胞,最好是骨髓瘤细胞系、转化B细胞、人胚胎肾细胞系或杂交瘤。用于这些细胞的表达载体可以包括表达控制序列,例如复制原点、启动子、增强子和必需的加工信息位点如核糖体结合位点、RNA剪接位点、聚腺苷酸化位点和转录终止子序列。优选的表达控制序列是来自免疫球蛋白基因、SV40、腺病毒、牛乳头瘤病毒、巨细胞病毒等等的启动子。
可以通过众所周知的方法将包含目标核苷酸序列(如重链和轻链编码序列以及表达控制序列)的载体转移进宿主细胞,所使用的方法根据细胞宿主类型而不同。例如,氯化钙转染一般用于原核细胞,而磷酸钙处理或电穿孔可用于其它细胞宿主。
一旦表达本发明的完整抗体、其二聚体、各个轻链和重链或其它免疫球蛋白形式后,就可以根据本领域内标准程序纯化它们,所述程序包括硫酸铵沉淀、离子交换、亲和层析、反相层析、疏水相互作用柱层析、凝胶电泳等等。对于药物应用,优选具有至少约90到95%同质性的基本纯免疫球蛋白、最优选具有98到99%或更高同质性。一旦根据需要部分纯化所述多肽或纯化所述多肽至同质性后,可以如本文所述将所述多肽用于治疗或预防。
使用标准给药技术,将所述抗体(包括免疫反应性片段)给予表现Aβ相关症状或疾病或受到所述症状或疾病威胁的个体,所述症状或疾病例如临床或临床前阿耳茨海默氏病、Down氏综合征、或临床或临床前淀粉样血管病,所述标准给药技术最好是通过静脉内给予、腹膜内给予、皮下给予、肺部给予、经皮给予、肌内给予、鼻内给予、口腔含化给药法、舌下给予或栓剂给予(suppository administration)进行外周给药(即不给予中枢神经系统)。虽然可以将所述抗体直接给予脑室系统、脊髓液或脑实质,并且对这些位置给药的技术是本领域内众所周知的,但不必利用这些更困难的程序。当通过依赖于外周循环系统的更简单技术给予时,本发明抗体是有效的。本发明的优点包括所述抗体能够在甚至不直接提供给中枢神经系统本身的情况下发挥其有益的效果。而本文确实已经证明:穿过血脑屏障的抗体量低于血浆水平的0.1%,而本发明抗体表现出能够螯合外周循环中的Aβ,并且改变CNS和血浆中溶解性Aβ的清除。
设计用于给药的药用组合物,使其适于选定的给药模式,合适地使用药学上可接受的赋形剂如分散剂、缓冲剂、表面活性剂、防腐剂、增溶剂、等张剂、稳定剂等等。Remington’s Pharmaceutical Science,Mack Publishing Co.,Easton PA,最新版,通过引用结合到本文中,提供医师众所周知的制剂技术纲要。改变本发明抗体的溶解度特性是特别有用的,例如通过将它们包囊在脂质体中,或通过封闭极性基团而使它们更加亲脂。
优选通过静脉内注射或腹膜内注射或皮下注射进行的外周系统性传递。用于所述注射剂的合适媒介是简单的。然而,此外,可以采用鼻气雾剂或栓剂的方法通过粘膜进行给药。用于所述给药模式的合适制剂是众所周知的,所述制剂一般包括便利跨膜转运的表面活性剂。所述表面活性剂常常是类固醇衍生物或者是阳离子脂类,例如N-[1-(2,3-二油酰基)丙基-N,N,N-三甲基氯化铵(DOTMA)或各种化合物如半琥珀酸胆固醇酯、磷脂酰甘油等等。
制剂中人源化抗体的浓度低至约0.1%重量比,高至15或20%重量比,该浓度主要根据液体体积、粘度等等,按照选定的具体给药模式选择。因此,典型的注射用药用组合物将包含1mL磷酸缓冲盐水的无菌缓冲水和1-100mg本发明人源化抗体。制造所述制剂后,无菌过滤,或用其它方法处理使其在微生物学上可接受。典型的用于静脉内输注的组合物可包括高至250mL液体体积,如无菌Ringer氏溶液,以及1-100mg/mL或更高的抗体浓度。
本发明的治疗剂可以冷冻或冻干保存,然后使用前用合适的无菌载体重建。冻干和重建会导致不同程度的抗体活性丧失(如对于常规免疫球蛋白,IgM抗体的活性丧失比IgG抗体更严重)。可能需要调整剂量以进行补偿。选择所述制剂的pH以平衡抗体稳定性(化学和物理稳定性)并使其在给予患者时更舒服。一般地说,4到8之间的pH是可以接受的。
虽然前述方法看起来对于给予蛋白如人源化抗体是最方便和最合适的,但其它给药技术(如经皮给药和口服给药)经过改进后,只要设计合适的制剂,也可以使用。
此外,比较理想的是采用控释制剂,所述控释制剂使用生物可降解膜和基质、或渗透性微型泵、或基于葡聚糖珠、藻酸盐或胶原蛋白的传递系统。
总的来说,可以获得用于给予本发明抗体的制剂,所述制剂是本领域内众所周知的,可以从多种选择中选出合适的制剂。
可以使用标准临床技术最优化一般剂量水平,并且一般剂量水平取决于给药模式和患者的状况。
下面的实施例将举例说明本发明而不是限制本发明。
其中下文的实施例使用名为“266”的小鼠单克隆抗体,该抗体最初通过用包含人Aβ肽残基13-28的肽接种而制备。已经证实该抗体与所述肽发生免疫反应,但以前报道该抗体不与仅包含人Aβ肽残基17-28的肽、或在所述Aβ肽内其它任何表位上反应。美国专利5,766,846描述了该抗体的制备,通过引用结合到本文中。由于本文的实施例描述在小鼠系统内进行的实验,使用小鼠单克隆抗体是令人满意的。然而,在本发明应用于人类的治疗方法中,优选具有对应于抗体266的免疫特异性的人源化形式抗体。
实施例1
螯合人类体液中加入的Aβ肽
如下在室温下温育人脑脊髓液(CSF)样品(50μl)和人血浆样品1小时:
1.单独温育;
2.与5ng Aβ40肽一起温育;或
3.5ng Aβ40肽和1mg单克隆抗体266(在例如美国专利5,766,846中描述,通过引用结合到本文中)。
所述样品随后在4-25%非变性梯度胶上电泳(即非变性梯度电泳(NDGGE)),然后转移到硝酸纤维素上。所述印迹随后用Ponceau S染色或者用针对Aβ肽头五个氨基酸的生物素标记单克隆抗体(3D6)探测(蛋白质印迹分析),用链霉抗生物素-辣根过氧化物酶显象,然后通过增强化学发光(ECL)检测。根据Pharmacia分子量标记估计所述印迹带中所包含材料的水合直径。因此,假如所述Aβ肽结合其它分子,它将按照所得复合物的大小迁移。
用或不用5ng Aβ肽对CSF进行的蛋白质印迹显示:没有证据表明Aβ肽响应由抗体3D6介导的检测。对于人血浆获得相似的结果。尽管对于同样的CSF样品,使用同样技术通过SDS-PAGE以及随后的蛋白质印迹可以检测到Aβ肽,但这是事实。大概是该肽与所检测液体中其它因子的相互作用阻止对Aβ肽的检测。然而,当在温育物中加入Mab 266,代表与所述抗体复合的螯合Aβ肽的特征带在血浆和CSF中同时存在。主要带约11nm水合直径,对应于抗体单体,另有一个13nm的小带,对应于抗体二聚体。
实施例2
螯合抗体的特异性
使用含50μl人CSF或10μl APPV717F CSF的样品。APPV717F是转基因小鼠,代表阿耳茨海默氏病的小鼠模型,在该模型中表达带有家族性阿耳茨海默氏病突变的人淀粉样蛋白前体转基因,从而导致在中枢神经系统中产生人Aβ肽。
如实施例1所述,将所述样品在存在或不存在各种Mab(1μg)的情况下于室温下温育1小时,然后在4-25%NDGGE上电泳,随后在硝酸纤维素上形成印迹。所述抗体如下:
Mab 266(结合位置13-28);
Mab 4G8(结合位置17-24);
QCBpan(针对位置1-40的兔多克隆抗体);
小鼠IgG(非特异性);
Mab 3D6(结合位置1-5);
Mab 21F12(结合位置33-42);
Mab 6E10(结合位置1-17);和
QCB40,42(针对Aβ40和Aβ42的兔多克隆抗体)。
如实施例1所述检测Aβ肽抗体复合物:首先使用生物素标记的3D6(针对Aβ肽N-末端),随后使用链霉抗生物素蛋白-HRP和ECL。在人CSF中的相似检测与Mab 266一起温育,在某些情况下用结合Aβ肽羧基末端的QCB40,42取代3D6。
结果显示:在测试的抗体中,只有在Mab 4G8和Mab 266的情况下检测到Aβ肽。
结果显示:对于人CSF,只有Mab 266和Mab 4G8能够以可检测到的量螯合抗体Aβ复合物(同样,在没有抗体存在的情况下,检测不到Aβ)。Mab 266也能够对于使用人CSF、APPV717F转基因小鼠CSF的实验产生相似结果。不论是否使用3D6或QCB40,42抗体显影蛋白质印迹,使用Mab 266都能够螯合人CSF中的Aβ肽。
实施例3
通过双向电泳显示Aβ肽-266复合物
包含50ng Aβ40肽的样品与2μgMab266在37℃温育3小时。对应地单独温育Mab 266作为对照。
然后对所述样品进行双向凝胶电泳。
在第一向,如实施例1所述对所温育的样品进行NDGGE。将聚丙烯酰胺凝胶以垂直于第一向的方向切成单独的泳道,然后在变性/还原条件下,通过SDS-PAGE(Tricine尿素凝胶)在第二向进行凝胶分离。通过Ponceau-S染色(任何蛋白),或通过在基于HRP的检测系统中使用6E10Mab(Senetek,Inc.)和生物素化抗小鼠Aβ进行特异性显影,检测带的存在。
转移后对硝酸纤维素印迹进行Ponceau-S染色,使Mab 266的重链和轻链可见。经证实,Aβ肽与Mab 266形成复合物,表现为一条4kD的带,该带与第一向NDGGE后看到的全长Mab 266的大小对齐。
实施例4
证明在结合与螯合之间没有对等性
人们认为当Aβ肽在血浆和CSF中循环时,它与蛋白质形成复合物,所述蛋白质包括载脂蛋白E。本实施例证明:针对apoE的抗体虽然能够结合所述复合物,但不能螯合分离apoE与所述复合物的其它部分。
将ApoE复合物(500ng)与针对apoE的Mab或多克隆抗体(2μg)在37℃温育1小时。然后使用在实施例1中描述的技术,对所温育的样品进行NDGGE。NDGGE后,用亲和纯化的山羊抗apoE抗体进行蛋白质印迹分析,通过ECL检测。当不存在抗体时,检测到apoE处在8-13nm,该直径与其以脂蛋白颗粒存在一致。针对apoE的单克隆抗体或多克隆抗体的存在导致apoE群体漂移到更大的分子,即“超级漂移(super shift)”。这证明:针对apoE的抗体并不螯合分开apoE与脂蛋白颗粒(即从脂蛋白颗粒去除apoE),而是结合于脂蛋白上的apoE,产生更大的分子。
实施例5
抗apoE抗体并不干扰对Aβ的螯合
100μl人CSF样品或者仅与Mab 266、或者与多克隆抗apo-E、或者与这两种抗体一起在37℃温育60分钟。随后如实施例1所述通过NDGGE分析所述样品,如实施例1所述检测带。
结果显示:只要Mab 266加入所述样品中,螯合的266-Aβ肽复合物约11nm直径的特征带是可见的。不论抗apoE存在与否,情况都是如此。在Mab 266存在的情况下,假如在所述温育混合物中加入50ng Aβ肽,仍然出现代表受螯合Aβ的该带。因此,抗apoE抗体的存在对apoE分子量的改变并不干扰Mab 266螯合Aβ肽。
实施例6
体内螯合Aβ肽
A.转基因APPV717F小鼠也称为PDAPP小鼠,该小鼠过度表达人APP蛋白的突变体形式。这些小鼠在CNS中产生人Aβ,在CSF和血浆中循环的人Aβ肽水平提高。对八月龄小鼠静脉内注射盐水或100μg Mab 266。所述小鼠在初次注射10分钟后取血,初次注射20小时后再次取血。
如实施例1所述,通过NDGGE和使用抗体3D6的蛋白质印迹,分析来自每只动物的20μl血浆样品。注射盐水的动物在10分钟或20小时后都不显示螯合Aβ肽特征性11nm带的存在。然而,注射Mab 266的两只动物在20小时后确实显示该带的存在。
B.该研究使用两月龄APPV717F小鼠。第0天,小鼠或者不接受Mab 266、或者接受1mg Mab 266、或者接受100μg该抗体。在给予所述抗体前两天以及在第1、3、5和7天取血浆样品。如实施例1所述,所述血浆样品进行NDGGE,然后用3D6进行蛋白质印迹分析和检测。在给予Mab 266后的所有时间点,除非血浆样品已经用蛋白G处理,否则都检测到266/Aβ复合物,蛋白G结合免疫球蛋白,因此有效去除Mab 266。复合物水平在测试时间内保持稳定,只是在注射100μg Mab 266的动物中在第7天有轻微下降;一般地说,给予100μg该抗体的动物体内的水平总是比给予1mg该抗体的小鼠体内发现的水平低。
C.静脉内给予两月龄APPV717F小鼠1mg Mab 266,从每只小鼠取25μl血浆样品。如上文所述对所述血浆样品进行NDGGE,然后进行蛋白质印迹分析,不同之处是生物素化3D6结合后用链霉抗生物素125I(Amersham)检测,然后暴露于荧光成像屏。根据与标准曲线的比较估计复合物水平,标准曲线如下制备:用已知量Aβ与饱和水平Mab 266结合并相似检测。据估计,结合Mab 266的Aβ肽的量是约100ng/ml,比以前测定的这些小鼠中的内源Aβ肽水平约100pg/ml增加约1000倍。这也与APPV717F脑中Aβ沉积前的Aβ肽水平(50-100ng/g)相似;APPV717F Tg小鼠中的人APP和人Aβ几乎仅在脑中产生。因此,看起来Mab 266在血浆中的存在象是Aβ肽接受器,便利Aβ肽从CNS到血浆的净流出。所述增加的净流出可能是由于Aβ从CNS到血浆的流出增加,同时防止血浆中的Aβ再次进入脑。
如下确认螯合Aβ肽的正确大小:APPV717F小鼠注射1mg Mab 266后24小时获得的20μL血浆样品在TRIS-tricine SDS-PAGE凝胶上电泳,在使用结合蛋白G的珠暴露于蛋白G之前或之后,用抗Aβ抗体6E10进行蛋白质印迹分析。检测到蛋白G除去的带位于4-8kD,与Aβ肽单体、可能有二聚体的存在一致。
D.用PBS(n=7)或者500μg生物素化Mab 266(即m266B)(n=9)腹膜内处理两月龄APPV717F小鼠。在注射前和注射后24小时,使用Johnson-Wood,K.等,Proc.Natl.Acad.Sci.USA(1997)94:1550-1555;和Bales,K.R.等,Nature Genet(1997)17:263-264的ELISA方法的改进形式,分析血浆中的总Aβ肽。通过用m3D6包被的96孔Optiplate(Packard,Inc.)测量结合m266B的总Aβ。稀释的血浆样品和标准品(各种浓度的Aβ40和m266B)在所述包被的板中温育过夜,应用125I-链霉抗生物素测定总Aβ/m266B复合物的量。此外,在24小时的时间点,首先用蛋白G处理血浆样品以定量未结合Mab 266的Aβ肽,然后通过ELISA测定CSF中的AβTotal和Aβ42。在注射PBS的动物中,注射前后血浆Aβ肽水平都是140pg/ml。注射Mab 266的小鼠体内血浆水平在注射前相似,但未结合Mab 266的Aβ肽的水平在注射后24小时检测不到。
还测量了CSF中的水平,CSF代表CNS内的细胞外区室,CSF中的分子浓度在某种程度上反映脑内细胞外空间中的物质浓度。从小脑延髓池区室分离CSF。用戊巴比妥麻醉小鼠,取出从头颅骨基部到第一椎骨的肌肉系统。如下收集CSF:在解剖显微镜下,用微量针小心刺穿覆盖延髓池的蛛网膜,吸取CSF到聚丙烯微量移液管中。注射24小时后,发现注射Mab 266的小鼠的CSF中总Aβ肽增加,与注射PBS的小鼠相比,在CSF中获得的Aβ42增加约两倍。使用变性凝胶电泳以及随后使用Aβ42特异性抗体21F12的蛋白质印迹分析确认了这一点。
在另一个实验中,三月龄APPV717F Tg小鼠静脉内注射PBS或者Mab 266,如下评价CSF中的Aβ40水平和Aβ42水平:
为测量Aβ40,使用特异性针对Aβ40的单克隆抗体m2G3。用125I-链霉抗生物素取代链霉抗生物素-HRP试剂,改变文献所述ELISA方法(Johnson-Wood,K.等,Proc.Natl.Acad.Sci.USA(1997)94:1550-1555)成为RIA。对于血浆样品和CSF样品,在缓冲液中缺乏胍的非变性条件下进行所述程序。为评价脑匀浆中碳酸盐可溶和不溶性Aβ,样品与100mM碳酸盐,40mM NaCl,pH 11.5(4℃)匀浆,10,000xg离心15分钟,如文献所述(Johnson-Wood,K.等,Proc.Natl.Acad.Sci.USA(1997)94:1550-1555)和上文列出的程序,评价上清液(可溶)和沉淀(不溶性)中的Aβ。通过改良的RIA测量血浆中的Aβ/Mab 266复合物。对小鼠注射生物素化Mab 266(Mab 266B),在多个时间点分离血浆。通过用m3D6包被的96孔Optiplate(Packard,Inc.)测量结合Mab266的总Aβ。稀释的血浆样品和标准品(各种浓度的Aβ40和Mab266B)在所述包被的板中温育过夜,应用125I-链霉抗生物素测定总Aβ/Mab266B复合物的量。
静脉内注射Mab 266三小时后,CSF中Aβ40水平增加两倍,Aβ42没有显著增加。然而,在24小时和72小时,CSF中的Aβ40和Aβ42都增加两到三倍。使用变性凝胶分析和随后对汇集的CSF的Aβ蛋白质印迹分析获得相似结果。Aβ通过脑间隙液的流出(CSF水平在某种程度上反映出这种流出)可能引起所观察到的CSF Aβ增加。
意义重大的是,CSF Aβ肽水平的变化并不是由于Mab 266进入CSF引起的,因为在注射后24小时测量到的水平低于Mab 266血浆水平的0.1%,不足以引起这些变化。这些结果提示:抗体在血流中的存在引起Aβ肽流出脑实质,进入CSF。
在已经注射Mab 266并如上所述分析CSF的同一小鼠的脑皮质匀浆内,测量可溶于PBS或碳酸盐缓冲液的Aβ肽形式。观察到在皮质匀浆中这些溶解型的相似增加。
实施例7
Mab 266在体外作为Aβ肽接受器起作用
构建作为体外系统的透析室,测试Mab 266作为Aβ肽接受器的能力。将1mL人CSF置于聚丙烯管的顶室内,该顶室由一块特定截断值为10-100kD的透析膜将其与底室分开,底室内盛有含或不含1μg Mab 266的75μLPBS。
在不同时间点将底室内的物质加载到酸尿素凝胶,然后用6E10针对Aβ肽进行蛋白质印迹分析,看起来3小时后达到平衡。样品在蚁酸中变性,达到80%(体积比)的终浓度,然后用β-巯基乙醇(1%)还原。样品在0.9M乙酸电泳缓冲液内电泳(阳极到阴极)通过4%-35%的聚丙烯酰胺梯度凝胶,所述梯度凝胶含6M尿素、5%(体积比)冰乙酸和2.5%TEMED。转移到硝酸纤维素之前,中和凝胶的酸性pH。然后使用标准蛋白质印迹技术鉴定Aβ。检测到的带对应于4kD。
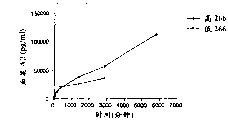
3小时后,通过ELISA分析顶室和底室(n=4),由此确定从顶室移除的Aβ的量。图1显示存在和不存在Mab 266的情况下,不同分子量截断值获得的结果。如图显示,虽然当将PBS置于底室内时仅有最小量的Aβ肽穿过膜,但当存在Mab 266、分子量截断值是25kD的情况下,50%的Aβ肽在底室中受到螯合;当分子量截断值增加到100kD时穿过膜的量增加,吸引几乎100%的Aβ肽穿过膜。
还观察到抗N末端Aβ抗体3D6和10D5能够在该系统中吸引Aβ肽穿过膜,虽然所述抗体不能在实施例1所述测定中螯合Aβ肽。这些结果显示:针对Aβ肽的抗体在这些条件下有足够亲和力螯合生理溶液中的所述肽,使其与其它结合蛋白质分离,但对于位置13-28的表位有免疫反应性的Mab如266实际上更有效、以更高亲和力结合。
在相似的测定中,如DeMattos,R.B.等,J.Biol.Chem.(1998)273:4206-4212;Sun,Y.等,J.Neurosci.(1998)18:3261-3272所述方法纯化的星形细胞分泌的apoE4对于增加底室内Aβ肽量有微小但在统计学上显著的效应。当用多克隆IgG或BSA取代Mab 266时,没有观察到明显效应。
实施例8
Aβ肽从CNS流出到血浆
A.将1μg Aβ40溶解于5μL小鼠CSF,保持其可溶,然后将其注射入野生型Swiss-Webster小鼠小脑延髓池的蛛网膜下腔,在此之前所述小鼠已经接受PBS(n=3)或200μg生物素化Mab 266(n=3)的静脉内注射。在处理后的不同时间点,通过AβELISA测定小鼠血浆中的AβTotal,在AβELISA中使用3D6作为包被抗体,并使用与过量生物素化266混合的Aβ标准品。从每只动物取出血浆样品后,将每份血浆样品与过量生物素化266混合,以在ELISA中进行Aβ检测。在注射PBS的小鼠中,30-60分钟后检测到0.15ng/ml水平的峰值,即最低限度可检测量的肽,在此之后所述水平基本上是零。然而,在给予Mab 266的小鼠中,60分钟后血浆Aβ肽达到在注射PBS的小鼠中所检测到水平的330倍水平(约50ng/ml),在180分钟后达到约90ng/ml的值。
B.将200μg(n=3)或600μg(n=3)静脉内注射入两月龄APPV717F小鼠,重复该程序。以上述剂量将Mab 266静脉内注射入3月龄APPV717F+/+小鼠。在静脉注射前和注射后的不同时间点,通过RIA测定结合Mab 266的Aβ血浆浓度。图2显示来自一只有代表性的小鼠的详细结果。
发现结合单克隆抗体Mab 266的Aβ的浓度在4天内从150pg/ml的基础水平增加到超过100ng/ml的水平。通过分析该曲线上的早期时间点,确定在存在饱和水平所述抗体的情况下,APPV717F Tg小鼠AβTotal进入血浆的净速率是42pg/ml/分钟。
Mab 266在野生型和APPV717F Tg小鼠体内对血浆Aβ水平的效应以及所述抗体对CSF中Aβ浓度的效应显示:循环Mab 266的存在改变CNS和血浆间Aβ流动或转运平衡。
实施例9
Mab 266对脑中Aβ的效应
对四月龄APPV717F+/+小鼠腹膜内注射盐水、Mab 266(500μg)或对照鼠IgG(100μg,Pharmigen),每2周处理一次,共进行5个月。在九月龄处死小鼠,测定皮质中的Aβ沉积。如Holtzman,D.M.等,Ann.Neurol.(2000)97:2892-2897所述,在用兔淘选Aβ抗体(QCB,Inc.)覆盖背海马后,立即定量皮质中所述抗体鉴定的呈现Aβ免疫反应性的面积%。结果显示于图3A。在该鼠龄,每组约一半动物仍然没有开始出现Aβ沉积。然而,在用266处理的组中,皮质中带有>50%Aβ的小鼠的%显著更少(P=0.02,x2检验法)。虽然九月龄APPV717F小鼠出现大量Aβ沉积,但有很大可变性,约50%显示没有沉积,约50%显示有大量沉积。在PBS和IgG处理的动物中,6/14和5/13小鼠有超过50%皮质被Aβ染色覆盖,而用Mab 266处理的14只小鼠中仅有一只达到该染色水平。在9月龄时,所有组中几乎50%的动物没有发展出Aβ沉积。后者看起来是由于我们使用的实验动物中各个小鼠的亲本来源,因为即使研究的所有小鼠都证实是APPV717F+/+,但仅在从4/8育种对获得的小鼠中观察到高水平Aβ沉积(高病理幼仔)。来自其它4个育种对的小鼠看起来没有Aβ沉积(低病理幼仔)。使用亲本来源作为共变量,M266对于降低Aβ沉积有强烈、显著的效应(p=0.0082,图3B)。
实施例10
在APPV717F Tg小鼠中外周注射Mab并不结合淀粉样斑
为确定在5个月内腹膜内注射的Mab 266是否结合脑中的Aβ,利用来自包含Aβ沉积并且已经用Mab 266、盐水或对照IgG治疗的9月龄APPV717F+/+Tg小鼠的脑切片。如文献所述进行组织加工和免疫染色(Bales,K.R.等,Nature Genet.(1997)17:263-264)。用荧光素标记的抗小鼠IgG(Vector,Inc.)温育来自所有组动物的组织,然后在荧光显微镜下检查。在任何组中没有观察到Aβ沉积的特异性染色。与此相反,当在用抗小鼠IgG温育所述切片前应用Mab 266于所述切片,则可以清楚地检测到Aβ沉积。
实施例11
给予抗体266对于24月龄转基因半合子PDAPP小鼠的认知的效应
使用16只半合子转基因小鼠(APPV717F)。研究开始时所述小鼠约24月龄。所有注射都是腹膜内注射(i.p.)。一半小鼠每周注射磷酸盐缓冲液(PBS,“对照”),另一半接受溶解于PBS中的500微克小鼠抗体266。注射在7周(42天)内进行,总共注射6次。最后一次注射后3天,基本如J.-C.Dodart等,Bahavioral Neuroscience,113(5)982-990(1999)所述,使用目标认知任务评价动物行为。计算认知指数(TB x 100)/(TB-TA)。结果显示于下面表1。
表1.认知指数的统计学描述
认知指数(分钟)
**p=0.0010
对24月龄半合子转基因小鼠每周给予500微克抗体266与行为显著变化有关。抗体处理的转基因小鼠具有与野生型对照动物相似的认知指数[J.-C.Dodart等]。认知指数上的差异在0.001概率水平上具有统计学显著性。认知指数的增加表明:用结合β淀粉样蛋白肽氨基酸13-28区的抗体处理将逆转在该阿耳茨海默氏病小鼠模型中记录到的行为障碍。因此,给予结合β淀粉样蛋白肽氨基酸13-28区的抗体将治疗疾病如阿耳茨海默氏病和Down氏综合征,并将阻止通常与疾病进程有关的认知下降。
如上所述,用小鼠抗体266处理7周的24月龄动物的脑海马(包括扣带区和顶皮质)覆盖后,立即定量皮质中的淀粉样蛋白负荷(用抗Aβ抗体3D6或21F12染色后被免疫反应性材料覆盖的面积%)。结果显示于下表。处理组间的差异在统计学上并不显著。
表2.用小鼠266抗Aβ抗体处理后APP
V717F+/-
小鼠中的淀粉样斑
负荷
淀粉样斑负荷(%)
对于这些年龄非常大的动物,根据用3D6或21F12测量,用小鼠抗体266处理与PBS处理组相比并不导致显著不同的淀粉样负荷。此外,与更年轻的动物中的淀粉样蛋白负荷相比,Aβ负荷确实更多并且显著增加(见下文),所述更年轻的动物在目标认知任务中不能分辨新对象与熟悉的对象。最惊人的是,这些结果证明:抗Aβ抗体能够逆转认知缺陷,而不需降低淀粉样负荷本身。
处理7周后,m266处理组的认知指数与24月龄野生型动物预期的认知指数没有显著不同!这指出在这些转基因动物中完全逆转认知下降。
实施例12
给予抗体266对于年轻转基因半合子PDAPP小鼠的认知的效应
使用五十四(54)只纯合子转基因小鼠(APPV717F)。二十三(23)只小鼠在研究开始时约二月龄。其余小鼠在研究开始时约四月龄。处理时间五个月。因此,在研究终止时,小鼠约七(7)个月龄或约九(9)个月龄。
所有注射都是腹膜内注射(i.p.)。每只“PBS”对照组的小鼠每周接受磷酸盐缓冲溶液注射(PBS;200μL)。“IgG”对照组的每只小鼠每周接受IgG1κ1同种型对照注射(100μg/小鼠/周)。每只“高剂量”组的小鼠每周接受溶解于PBS中的500微克抗体266注射(“HD”)。“低剂量组”中的每只小鼠每周接受溶解于PBS中的100微克抗体266注射(“LD”)。如上面实施例10所述,最后一次注射后三天,使用目标识别任务评价动物行为,计算辨别指数,辨别指数是花费在新对象上和花费在熟悉对象上的时间差异。结果显示于下表3。结果按照研究结束时小鼠的年龄分组。
表3.辨别指数的统计学描述
辨别指数(分钟)
*p<0.05
***p<0.0001
将这些数据结合起来,支持这样一个结论:给予针对Aβ中间域的抗体266缓解7-9月龄APPV717F转基因小鼠中的斑沉积,并逆转以前特征鉴定的行为损害。用针对Aβ肽中间域的抗体治疗患者将抑制或防止一般与疾病进程有关的认知下降,并逆转所述认知下降。
受处理动物的辨别指数与同龄野生型小鼠预期的辨别指数在统计学上没有显著不同。因此,就如在更老的动物中一样(实施例10),用m266处理在这些更年轻的转基因动物中完全逆转认知下降。
实施例13
合成人源化抗体266
细胞和抗体。从ATCC(Manassas,VA)获得小鼠骨髓瘤细胞系Sp2/0,置于37℃CO2培养箱中,在含10%FBS(Cat#SH32661.03,HyClone,Logan,UT)的DME培养基中维持。小鼠266杂交瘤细胞首先在含10%FBS(HyClone),10mM HEPES,2mM谷氨酰胺,0.1mM非必需氨基酸,1mM丙酮酸钠,25μg/ml庆大霉素的RPMI-1640培养基中培养,然后在含2%低Ig FBS(Cat#30151.03,HyClone)的无血清培养基(Hybridoma SFM,Cat#12045-076,Life Technologies,Rockville,MD)中扩展到滚瓶中的2.5升体积。使用蛋白G Sepharose柱,通过亲和层析从所述培养物上清纯化小鼠单克隆抗体266(Mu266)。使用EZ-Link Sulfo-NHS-LC-LC-生物素(Cat#21338ZZ,Pierce,Rockford,IL)制备生物素化Mu266。
克隆不同区cDNA。使用TRIzol试剂(Life Technologies)从约107杂交瘤细胞提取总RNA,使用PolyATract mRNA分离系统(Promega,Madison,WI),按照供应商的方法分离poly(A)+RNA。使用SMARTTMRACE cDNA扩增试剂盒(Clontech,Palo Alto,CA),按照供应商的方法合成双链cDNA。使用分别与小鼠κ链和γ链恒定区退火的3′引物,以及在SMARTTM RACE cDNA扩增试剂盒中提供的5′通用引物,通过聚合酶链反应(PCR)扩增轻链和重链的可变区cDNA。对于VLPCR,3′引物具有如下序列:
5′-TATAGAGCTCAAGCTTGGATGGTGGGAAGATGGATACAGTTGGTGC-3′
[SEQ ID NO:13]
其中残基17-46与小鼠Ck区杂交。对于VH PCR,3′引物具有如下简并序列:
A G T
5′-TATAGAGCTCAAGCTTCCAGTGGATAGACCGATGGGGCTGTCGTTTTGGC-3′
T
[SEQ ID NO:14]
其中残基17-50与小鼠γ链CH1杂交。将VL和VH cDNA亚克隆入pCR4Blunt-TOPO载体(Invitrogen,Carlsbad,CA),进行序列测定。使用荧光双脱氧链终止剂(Applied Biosystems,Foster City,CA),按照厂家的指导通过PCR循环测序反应进行DNA测序。在377型DNA测序仪(Applied Biosystems)上分析所述测序反应。
构建人源化266(Hu266)可变区。如Queen等[Proc.Natl.Acad.Sci.USA 86:10029-10033(1988)]所述人源化小鼠抗体V区。根据序列同源性,选择人V区构架作为Mu266CDR的受体。使用计算机程序ABMOD和ENCAD[Levitt,M.,J.Mol.Biol.168:595-620(1983)]构建可变区的分子模型。用Mu266的对应残基取代人源化V区中预期接触CDR的氨基酸。取代重链残基46、47、49和98,取代轻链残基51。将人源化V区中在同一V区亚型内稀有的氨基酸取代为共有氨基酸,消除可能的免疫原性。取代轻链残基42和44。
使用长度从约65碱基到80碱基的八种重叠合成寡核苷酸,构建和扩增轻链和重链可变区基因[He,X.Y.等,J.Immunol.160:029-1035(1998)]。所述寡核苷酸成对退火,用DNA聚合酶I的Klenow片段延伸,产生四个双链片段。变性所获得的片段,成对退火,然后用Klenow延伸,产生两个片段。变性这些片段,成对退火,再次延伸,产生全长基因。使用延伸高保真PCR系统(Roche MolecularBiochemicals,Indianapolis,IN),通过PCR扩增所得产物。所述PCR扩增片段通过凝胶纯化并克隆进pCR4Blunt-TOPO载体。确认序列后,用MIu I和Xba I消化所述VL和VH基因,凝胶纯化,分别亚克隆进用于表达轻链和重链的载体,产生pVk-Hu266和pVg1-Hu266(分别见本文的图6和图7)[Co,M.S.等,J.Immunol.148:1149-1154(1992)]。从这些质粒表达的成熟人源化266抗体具有SEQ ID NO:11的轻链和SEQ ID NO:12的重链。
稳定转染。使用Gene Pulser仪器(BioRad,Hercules,CA),如所述(Co等,1992)应用360V和25μF,通过电穿孔完成对小鼠骨髓瘤Sp2/0的稳定转染。转染前,用Fsp I线性化pVk-Hu266和pVg1-Hu266质粒DNA。用20μg pVk-Hu266和40μgpVg1-Hu266转染约107Sp2/0细胞。将转染细胞悬浮于含10%FBS的DME培养基,然后接种几个96孔板。48小时后,应用选择培养基(含10%FBS,HT培养基补加剂,0.3mg/ml黄嘌呤和1μg/ml霉酚酸的DME培养基)。开始选择后约10天,如下所述通过ELISA分析培养物上清中的抗体生成。高产量克隆在含10%FBS的DME培养基中扩增,然后进一步分析抗体表达。选定克隆然后在杂交瘤SFM中培养。
通过ELISA测量抗体表达。用100μl在0.2M碳酸钠-碳酸氢钠缓冲液(pH 9.4)中的1μg/ml山羊抗人IgG、Fcγ片段特异性多克隆抗体(Cat#109-005-098,Jackson ImmunoResearch,West Grove,PA)包被96孔ELISA板(Nunc-Immuno板,Cat#439454,NalgeNunc,Naperville,IL),在4℃过夜。用洗涤缓冲液(含0.1%Tween 20的PBS)洗孔后,用400μl Superblock封闭缓冲液(Cat#37535,Pierce)封闭孔30分钟,然后用洗涤缓冲液洗涤。用ELISA缓冲液(含1%BSA和0.1%Tween 20的PBS)合适稀释含Hu266的样品,然后应用于ELISA板(每孔100μl)。使用人源化抗CD33IgG1单克隆抗体HuM195(Co等,1992,见上文)作为标准品。所述ELISA板在室温下温育2小时,然后用洗涤缓冲液洗孔。然后将100μl ELISA缓冲液中的1/1,1000稀释HRP缀合山羊抗人κ多克隆抗体(Cat#1050-05,Southern Biotechnology,Birmingham,AL)应用于每个孔。每孔在室温下温育1小时并用洗涤缓冲液洗涤后,每孔中加入100μl ABTS底物(Cat#507602和Cat#506502,Kirkegaard and Perry Laboratories,Gaithersburg,MD)。在每孔中加入100μl 2%草酸,终止显色。使用OPTImax微量滴定板读数器(Molecular Devices,Menlo Park,CA),在415nm读出吸光度值。
纯化Hu266。将其中一个高度表达Hu266的Sp2/0稳定转染子(克隆1D9)改为在杂交瘤SFM中培养,然后扩展到滚瓶中的2升。当细胞生存力达到10%或更低时,收获用过的培养物上清,并加载到蛋白A Sepharose柱。用PBS洗涤该柱,然后用0.1M甘氨酸-HCl(pH 2.5),0.1M NaCl洗脱抗体。洗脱蛋白对2升PBS透析,更换3次,然后过滤通过0.2μm滤膜,随后于4℃贮存。通过在280nm处测量吸光度确定抗体浓度(1mg/ml=1.4A280)。根据标准程序,在4-20%梯度胶(Cat#EC6025,Novex,San Diego,CA)上,在Tris-甘氨酸缓冲液中进行SDS-PAGE。减少纯化的人源化266抗体,在SDS-PAGE凝胶上电泳。整个抗体显示分子量约25kDa和50kDa的两条带。这些结果与根据氨基酸组成计算的轻链和重链或重链片段的分子量一致。
实施例14
人源化266抗体的体外结合特性
在一个比较ELISA中,比较小鼠266抗体(用生物素化小鼠266抗体)与如上所述合成并纯化的人源化266抗体的结合效能。用100μl在0.2M碳酸钠/碳酸氢钠缓冲液(pH 9.4)中缀合BSA的β-淀粉样蛋白肽(1-42)(10μg/ml)包被96孔ELISA板(Nunc-Immuno板,Cat#439454,NalgeNunc),在4℃过夜。如下制备所述Aβ1-42-BSA缀合物:将7.5mg Aβ1-42-Cys43(C末端半胱氨酸Aβ1-42,AnaSpec)溶解于500μL二甲基亚砜,然后立即加入1,500μL蒸馏水。将两(2)毫克马来酰亚胺激活的牛血清白蛋白(Pierce)溶解于200μL蒸馏水。完全混合两种溶液,在室温下静置两(2)小时。使用凝胶层析柱将未反应的肽与Aβ1-42-Cys-BSA缀合物分离开。
使用ELISA板洗涤器,用含0.1%Tween 20的磷酸盐缓冲液(洗涤缓冲液)洗孔,然后每孔加入300μL Superblock试剂(Pierce)封闭孔。封闭30分钟后,用洗涤缓冲液洗孔,除去多余液体。
一式三份,加入在ELISA缓冲液中生物素化Mu266(0.3μg/ml终浓度)和竞争抗体(Mu266或Hu266;开始终浓度为750μg/ml,顺序3倍稀释)的混合物,每孔达到100μl终体积。作为无竞争物的对照,加入100μl 0.3μg/ml生物素化Mu266。作为背景对照,加入100μl ELISA缓冲液。所述ELISA板在室温下温育90分钟。用洗涤缓冲液洗板后,每孔加入100μl1μg/ml HRP缀合链霉抗生物素(Cat#21124,Pierce)。所述板在室温下温育30分钟,然后用洗涤缓冲液洗涤。为进行显色,加入100μl/孔ABTS过氧化物酶底物(Kirkegaard &Perry Laboratories)。加入100μl/孔2%草酸,终止显色。在415nm处读出吸光度值。吸光度值针对竞争物浓度的对数作图,使用本领域内众所周知的方法,作符合数据点的曲线(使用Prism),并确定每种抗体的IC50。
小鼠266的平均IC50是4.7μg/ml(三个独立实验,标准差=1.3μg/ml),人源化266的平均IC50是7.5μg/mL(三个独立实验,标准差=1.1μg/ml)。如上所述进行第二组的三个实验,测得小鼠266的平均IC50是3.87μg/mL(SD=0.12μg/mL),人266的平均IC50是4.0μg/mL(SD=0.5μg/mL)。在这些结果的基础上,我们得出结论:人源化266具有与小鼠抗体266非常相似的结合特性。因此,我们预期人源化266具有与小鼠266非常相似的体外和体内活性,并将在人体内表现与小鼠266在小鼠体内表现的相同效应。
实施例15
小鼠抗体266和4G8的体外结合特性
使用BIAcore生物传感器2000测定抗体亲和力(KD=Kd/Ka),用BIAevaluation(v.3.1)软件分析数据。使用N-乙基-N-二甲基氨丙基碳二亚胺和N-羟基琥珀酰亚胺(EDC/NHS),将捕获抗体(兔抗小鼠)通过游离氨基缀合到生物传感器芯片(CM5)流动细胞2的羧基上。将非特异性兔IgG缀合到流动细胞1上,作为背景对照。单克隆抗体被捕获,产生300共振单位(RU)。然后使淀粉样蛋白β1-40或1-42(BiosourceInternational,Inc.)以递减浓度(1000倍到0.1倍KD)流过所述芯片。为再生芯片,使用甘氨酸-HCl(pH 2)洗涤,从所述芯片上洗脱结合的抗Aβ抗体。使用不含淀粉样蛋白β的对照注射作为对照,以进行基线扣除。分析显示结合相和解离相的传感器克数(Sensorgram),确定Kd和Ka。使用该方法,发现小鼠抗体266对于Aβ1-40和对于Aβ1-42的亲和力都是4pM。4G8对Aβ1-40的亲和力是23nM,对Aβ1-42的亲和力是24nM。尽管266和4G8对Aβ的亲和力存在6000倍的差距,但它们都结合Aβ氨基酸13到28之间的表位,有效从人CSF中螯合Aβ。因此,在测定抗体螯合Aβ的能力以及提供本发明有利而惊人的益处时,极为重要的是表位的位置,而不是结合亲和力。
实施例16
使用Biacore方法和溶解性肽对小鼠抗体266的表位作图
BIAcore是测量分子相互作用的自动生物传感器系统[Karlsson R.等,J.Immunol.Methods 145:229-240(1991)]。BIAcore相对于其它结合测定的优点是可以测量抗原结合而不必标记或固定所述抗原(即所述抗原保持更接近天然的构象)。基本如上文实施例12所述,使用BIAcore方法评价各种淀粉样蛋白β肽片段与小鼠抗体266的结合,不同之处是:使用含Tween 20的HEPES缓冲盐溶液进行所有稀释,注射A□(BioSource International)的多种片段,并注射每种片段的单一浓度(440nM)。
淀粉样蛋白β片段1-28、12-28、17-28和16-25结合小鼠抗体266,而Aβ片段1-20、10-20和22-35并不结合。片段1-20、10-20和22-35以对Aβ这些区已知的表位特异性结合其它Mab。使用该方法,小鼠抗体266的结合表位看起来是位于Aβ的氨基酸17到25之间。由于结合通常发生在所述表位的至少3个残基,我们可以进一步推断所述表位在残基19-23之间。
实施例17
人源化抗体266的体外结合特性
基本如上文实施例15中所述,确定如上文合成和纯化的人源化266抗体的亲和力(KD=Kd/Ka)。使用该方法,发现人源化266对Aβ1-24的亲和力是4pM。
序列表
<110>ELI LILLY AND COMPANY和WASHINGTON UNIVERSITY
<120>螯合淀粉样蛋白β肽的人源化抗体
<130>8792/272
<140>中国01808430.3
<141>2002-08-21
<150>PCT/US01/06191
<151>2001-02-26
<150>60/184,601
<151>2000-02-24
<150>60/254,465
<151>2000-12-08
<150>60/254,498
<151>2000-12-08
<160>16
<170>PatentIn version 3.1
<210>1
<211>16
<212>PRT
<213>Mus sp.
<400>1
Arg Ser Ser Gln Ser Leu Ile Tyr Ser Asp Gly Asn Ala Tyr Leu His
1 5 10 15
<210>2
<211>7
<212>PRT
<213>Mus sp.
<400>2
Lys Val Ser Asn Arg Phe Ser
1 5
<210>3
<211>9
<212>PRT
<213>Mus sp.
<400>3
Ser Gln Ser Thr His Val Pro Trp Thr
1 5
<210>4
<211>5
<212>PRT
<213>Mus sp.
<400>4
Arg Tyr Ser Met Ser
1 5
<210>5
<211>17
<212>PRT
<213>Mus sp.
<400>5
Gln Ile Asn Ser Val Gly Asn Ser Thr Tyr Tyr Pro Asp Thr Val Lys
1 5 10 15
Gly
<210>6
<211>3
<212>PRT
<213>Mus sp.
<400>6
Gly Asp Tyr
1
<210>7
<211>113
<212>PRT
<213>人工序列
<220>
<223>人源化抗体
<220>
<221>MISC_FEATURE
<222>(2)..(2)
<223>位置2的Xaa是Val或Ile
<220>
<221>MISC_FEATURE
<222>(7)..(7)
<223>位置7的Xaa是Ser或Thr
<220>
<221>MISC_FEATURE
<222>(14)..(14)
<223>位置14的Xaa是Thr或Ser
<220>
<221>MISC_FEATURE
<222>(15)..(15)
<223>位置15的Xaa是Leu或Pro
<220>
<221>MISC_FEATURE
<222>(30)..(30)
<223>位置30的Xaa是Ile或Val
<220>
<221>MISC_FEATURE
<222>(50)..(50)
<223>位置50的Xaa是Arg、Gln,或Lys
<220>
<221>MISC_FEATURE
<222>(88)..(88)
<223>位置88的Xaa是Val或Leu
<220>
<221>MISC_FEATURE
<222>(105)..(105)
<223>位置105的Xaa是Gln或Gly
<220>
<221>MISC_FEATURE
<222>(108)..(108)
<223>位置108的Xaa是Lys或Arg
<220>
<221>MISC_FEATURE
<222>(109)..(109)
<223>位置109的Xaa是Val或Leu
<400>7
Asp Xaa Val Met Thr Gln Xaa Pro Leu Ser Leu Pro Val Xaa Xaa Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Xaa Tyr Ser
20 25 30
Asp Gly Asn Ala Tyr Leu His Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Xaa Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Xaa Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Xaa Gly Thr Xaa Xaa Glu Ile Lys
100 105 110
Arg
<210>8
<211>112
<212>PRT
<213>人工序列
<220>
<223>人源化抗体
<220>
<221>MISC_FEATURE
<222>(1)..(1)
<223>位置1的Xaa是Glu或Gln
<220>
<221>MISC_FEATURE
<222>(7)..(7)
<223>位置7的Xaa是Ser或Leu
<220>
<221>MISC_FEATURE
<222>(46)..(46)
<223>位置46的Xaa是Glu、Val、Asp或Ser
<220>
<221>MISC_FEATURE
<222>(63)..(63)
<223>位置63的Xaa是Thr或Ser
<220>
<221>MISC_FEATURE
<222>(75)..(75)
<223>位置75的Xaa是Ala、Ser、Val或Thr
<220>
<221>MISC_FEATURE
<222>(76)..(76)
<223>位置76的Xaa是Lys或Arg
<220>
<221>MISC_FEATURE
<222>(89)..(89)
<223>位置89的Xaa是Glu或Asp
<220>
<221>MISC_FEATURE
<222>(107)..(107)
<223>位置107的Xaa是Leu或Thr
<400>8
Xaa Val Gln Leu Val Glu Xaa Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Ser Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Xaa Leu Val
35 40 45
Ala Gln Ile Asn Ser Val Gly Asn Ser Thr Tyr Tyr Pro Asp Xaa Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Xaa Xaa Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Xaa Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Gly Asp Tyr Trp Gly Gln Gly Thr Xaa Val Thr Val Ser Ser
100 105 110
<210>9
<211>113
<212>PRT
<213>人工序列
<220>
<223>人源化抗体
<400>9
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Ile Tyr Ser
20 25 30
Asp Gly Asn Ala Tyr Leu His Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210>10
<211>112
<212>PRT
<213>人工序列
<220>
<223>人源化抗体
<400>10
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Ser Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Leu Val
35 40 45
Ala Gln Ile Asn Ser Val Gly Asn Ser Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Gly Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210>11
<211>219
<212>PRT
<213>人工序列
<220>
<223>人源化抗体
<400>11
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Ile Tyr Ser
20 25 30
Asp Gly Asn Ala Tyr Leu His Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210>12
<211>442
<212>PRT
<213>人工序列
<220>
<223>人源化抗体
<400>12
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Ser Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Leu Val
35 40 45
Ala Gln Ile Asn Ser Val Gly Asn Ser Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Gly Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
115 120 125
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
180 185 190
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
210 215 220
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
340 345 350
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210>13
<211>46
<212>DNA
<213>合成核苷酸
<400>13
tatagagctc aagcttggat ggtgggaaga tggatacagt tggtgc 46
<210>14
<211>50
<212>DNA
<213>合成核苷酸
<400>14
tatagagctc aagcttccag tggatagacc gatggggctg tcgttttggc 50
Claims (13)
1.一种人源化抗体,所述抗体包含SEQ ID NO:9给出序列的轻链可变区以及SEQ ID NO:10给出的重链可变区。
2.权利要求1的人源化抗体,所述抗体包含SEQ ID NO:11给出序列的轻链以及SEQ ID NO:12给出序列的重链。
3.权利要求1的人源化抗体,所述抗体是一种IgG1免疫球蛋白同种型。
4.一种核酸,它包含编码权利要求1的人源化抗体的轻链和重链的序列。
5.权利要求4的核酸,它包含编码SEQ ID NO:11所给出的轻链的序列。
6.权利要求4的核酸,它包含编码SEQ ID NO:12所给出的重链的序列。
7.权利要求4的核酸,它包含编码权利要求2的人源化抗体的轻链和重链的序列。
8.一种用于表达权利要求1或2的抗体的表达载体,所述载体包含编码所述抗体的核苷酸序列。
9.一种用权利要求8的表达载体转染的细胞。
10.一种药用组合物,所述药用组合物包含权利要求1或2任一项的人源化抗体和药学上可接受的赋形剂。
11.按照权利要求1或2任一项的人源化抗体在生产用于治疗临床或临床前阿耳茨海默氏病、Down氏综合征、或临床或临床前脑淀粉样血管病的药物中的应用。
12.按照权利要求1或2任一项的人源化抗体在生产用于治疗、预防或逆转临床或临床前阿耳茨海默氏病、Down氏综合征、或临床或临床前脑淀粉样血管病的认知力下降的药物中的应用。
13.权利要求1或2任一项的人源化抗体在生产治疗阿耳茨海默氏病的药物中的应用。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US18460100P | 2000-02-24 | 2000-02-24 | |
| US60/184,601 | 2000-02-24 | ||
| US25449800P | 2000-12-08 | 2000-12-08 | |
| US25446500P | 2000-12-08 | 2000-12-08 | |
| US60/254,465 | 2000-12-08 | ||
| US60/254,498 | 2000-12-08 | ||
| PCT/US2001/006191 WO2001062801A2 (en) | 2000-02-24 | 2001-02-26 | Humanized antibodies that sequester amyloid beta peptide |
Related Child Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201410322976.0A Division CN104341500A (zh) | 2000-02-24 | 2001-02-26 | 螯合淀粉样蛋白β肽的人源化抗体 |
| CN200810214672.7A Division CN101670105B (zh) | 2000-02-24 | 2001-02-26 | 螯合淀粉样蛋白β肽的人源化抗体 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1426423A CN1426423A (zh) | 2003-06-25 |
| CN1426423B true CN1426423B (zh) | 2010-05-12 |
Family
ID=27391859
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201410322976.0A Pending CN104341500A (zh) | 2000-02-24 | 2001-02-26 | 螯合淀粉样蛋白β肽的人源化抗体 |
| CN200810214672.7A Expired - Lifetime CN101670105B (zh) | 2000-02-24 | 2001-02-26 | 螯合淀粉样蛋白β肽的人源化抗体 |
| CN018084303A Expired - Lifetime CN1426423B (zh) | 2000-02-24 | 2001-02-26 | 螯合淀粉样蛋白β肽的人源化抗体 |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201410322976.0A Pending CN104341500A (zh) | 2000-02-24 | 2001-02-26 | 螯合淀粉样蛋白β肽的人源化抗体 |
| CN200810214672.7A Expired - Lifetime CN101670105B (zh) | 2000-02-24 | 2001-02-26 | 螯合淀粉样蛋白β肽的人源化抗体 |
Country Status (32)
| Country | Link |
|---|---|
| US (4) | US7195761B2 (zh) |
| EP (4) | EP1257584B2 (zh) |
| JP (2) | JP4738696B2 (zh) |
| KR (1) | KR100767146B1 (zh) |
| CN (3) | CN104341500A (zh) |
| AT (1) | ATE279442T1 (zh) |
| AU (1) | AU4178601A (zh) |
| BR (1) | BRPI0108676B8 (zh) |
| CA (1) | CA2400559C (zh) |
| CY (1) | CY1118381T1 (zh) |
| CZ (2) | CZ306683B6 (zh) |
| DE (2) | DE1257584T1 (zh) |
| DK (2) | DK1481992T3 (zh) |
| DZ (1) | DZ3295A1 (zh) |
| EA (1) | EA006606B1 (zh) |
| ES (2) | ES2611427T3 (zh) |
| HK (1) | HK1048640B (zh) |
| HR (2) | HRP20020693B1 (zh) |
| HU (2) | HUP0204074A3 (zh) |
| IL (3) | IL151378A0 (zh) |
| LT (1) | LT1481992T (zh) |
| MX (1) | MXPA02008145A (zh) |
| NO (2) | NO329840B1 (zh) |
| NZ (1) | NZ520800A (zh) |
| PL (2) | PL218883B1 (zh) |
| PT (2) | PT1481992T (zh) |
| SI (2) | SI1481992T1 (zh) |
| SK (2) | SK288711B6 (zh) |
| TR (1) | TR200202799T3 (zh) |
| UA (1) | UA75881C2 (zh) |
| WO (1) | WO2001062801A2 (zh) |
| ZA (1) | ZA200206712B (zh) |
Families Citing this family (195)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7964192B1 (en) | 1997-12-02 | 2011-06-21 | Janssen Alzheimer Immunotherapy | Prevention and treatment of amyloidgenic disease |
| US6913745B1 (en) | 1997-12-02 | 2005-07-05 | Neuralab Limited | Passive immunization of Alzheimer's disease |
| US20080050367A1 (en) * | 1998-04-07 | 2008-02-28 | Guriq Basi | Humanized antibodies that recognize beta amyloid peptide |
| US7179892B2 (en) * | 2000-12-06 | 2007-02-20 | Neuralab Limited | Humanized antibodies that recognize beta amyloid peptide |
| US7790856B2 (en) | 1998-04-07 | 2010-09-07 | Janssen Alzheimer Immunotherapy | Humanized antibodies that recognize beta amyloid peptide |
| US6761888B1 (en) * | 2000-05-26 | 2004-07-13 | Neuralab Limited | Passive immunization treatment of Alzheimer's disease |
| US6750324B1 (en) | 1997-12-02 | 2004-06-15 | Neuralab Limited | Humanized and chimeric N-terminal amyloid beta-antibodies |
| US6743427B1 (en) | 1997-12-02 | 2004-06-01 | Neuralab Limited | Prevention and treatment of amyloidogenic disease |
| US6787523B1 (en) | 1997-12-02 | 2004-09-07 | Neuralab Limited | Prevention and treatment of amyloidogenic disease |
| TWI239847B (en) * | 1997-12-02 | 2005-09-21 | Elan Pharm Inc | N-terminal fragment of Abeta peptide and an adjuvant for preventing and treating amyloidogenic disease |
| US20050059802A1 (en) * | 1998-04-07 | 2005-03-17 | Neuralab Ltd | Prevention and treatment of amyloidogenic disease |
| US20030147882A1 (en) | 1998-05-21 | 2003-08-07 | Alan Solomon | Methods for amyloid removal using anti-amyloid antibodies |
| US6787637B1 (en) | 1999-05-28 | 2004-09-07 | Neuralab Limited | N-Terminal amyloid-β antibodies |
| UA81216C2 (en) | 1999-06-01 | 2007-12-25 | Prevention and treatment of amyloid disease | |
| EP1409654B1 (en) | 1999-06-16 | 2008-08-20 | Boston Biomedical Research Institute | Immunological control of beta-amyloid levels in vivo |
| AU4178601A (en) | 2000-02-24 | 2001-09-03 | Univ Washington | Humanized antibodies that sequester abeta peptide |
| US7700751B2 (en) | 2000-12-06 | 2010-04-20 | Janssen Alzheimer Immunotherapy | Humanized antibodies that recognize β-amyloid peptide |
| TWI255272B (en) * | 2000-12-06 | 2006-05-21 | Guriq Basi | Humanized antibodies that recognize beta amyloid peptide |
| DE60229051D1 (de) * | 2001-04-30 | 2008-11-06 | Lilly Co Eli | Humanisierte antikörper |
| WO2002088306A2 (en) * | 2001-04-30 | 2002-11-07 | Eli Lilly And Company | Humanized antibodies |
| WO2003000714A2 (en) * | 2001-06-22 | 2003-01-03 | Panacea Pharmaceuticals, Inc. | Compositions and methods for preventing protein aggregation in neurodegenerative diseases |
| EP1420032B2 (en) † | 2001-08-03 | 2015-12-16 | Medical & Biological Laboratories Co., Ltd. | Antibody recognizing gm1 ganglioside-bound amyloid beta-protein and dna encoding the antibody |
| CA2457145C (en) * | 2001-08-17 | 2010-12-21 | Washington University | Assay method for alzheimer's disease |
| JP2005500389A (ja) * | 2001-08-17 | 2005-01-06 | イーライ・リリー・アンド・カンパニー | Aβに関連する病態および疾患を治療するための、可溶性Aβに高い親和性を有する抗体の使用 |
| CA2451998A1 (en) * | 2001-08-17 | 2003-02-27 | Eli Lilly And Company | Anti-a.beta. antibodies |
| ES2391905T3 (es) * | 2001-08-17 | 2012-11-30 | Washington University | Método de ensayo para la enfermedad de alzheimer |
| US20060073149A1 (en) * | 2001-08-17 | 2006-04-06 | Bales Kelly R | Rapid improvement of cognition in condition related to abeta |
| US7179606B2 (en) * | 2001-11-23 | 2007-02-20 | Syn X Pharma, Inc. | IG heavy chain, IG kappa, IG lambda biopolymer markers predictive of Alzheimer's disease |
| MY139983A (en) * | 2002-03-12 | 2009-11-30 | Janssen Alzheimer Immunotherap | Humanized antibodies that recognize beta amyloid peptide |
| AU2003223474B2 (en) * | 2002-04-25 | 2008-09-04 | Eli Lilly And Company | Method for treating anxiety and mood disorders in older subjects |
| WO2004029629A1 (en) * | 2002-09-27 | 2004-04-08 | Janssen Pharmaceutica N.V. | N-11 truncated amyloid-beta nomoclonal antibodies, compositions, methods and uses |
| FR2846667B1 (fr) * | 2002-11-06 | 2004-12-31 | Pasteur Institut | Fragments variables d'anticorps de camelides a chaine unique diriges contre le peptide beta-amyloide 1-42 et leurs applications pour le diagnostic et le traitement des maladies neuroagregatives |
| AU2003303198A1 (en) | 2002-12-19 | 2004-07-14 | New York University | Method for treating amyloid disease |
| DE10303974A1 (de) | 2003-01-31 | 2004-08-05 | Abbott Gmbh & Co. Kg | Amyloid-β(1-42)-Oligomere, Verfahren zu deren Herstellung und deren Verwendung |
| KR20050118669A (ko) * | 2003-02-01 | 2005-12-19 | 뉴랄랩 리미티드 | 가용성 a-베타에 대한 항체를 생성하기 위한 능동 면역화 |
| WO2004071408A2 (en) | 2003-02-10 | 2004-08-26 | Applied Molecular Evolution, Inc. | Aβ BINDING MOLECULES |
| US8663650B2 (en) | 2003-02-21 | 2014-03-04 | Ac Immune Sa | Methods and compositions comprising supramolecular constructs |
| US7732162B2 (en) | 2003-05-05 | 2010-06-08 | Probiodrug Ag | Inhibitors of glutaminyl cyclase for treating neurodegenerative diseases |
| TWI306458B (en) | 2003-05-30 | 2009-02-21 | Elan Pharma Int Ltd | Humanized antibodies that recognize beta amyloid peptide |
| AU2004260936B2 (en) | 2003-06-27 | 2010-06-10 | Amgen Fremont Inc. | Antibodies directed to the deletion mutants of epidermal growth factor receptor and uses thereof |
| KR101139103B1 (ko) * | 2003-09-12 | 2012-07-05 | 아피리스 아게 | 아페레시스 장치 |
| AT413336B (de) | 2003-09-12 | 2006-02-15 | Mattner Frank Dr | Apherese-vorrichtung |
| US7848543B2 (en) * | 2004-02-05 | 2010-12-07 | Brainlab Ag | Method and system for prediction and management of material and information transport in an organism |
| ATE534667T1 (de) * | 2004-02-23 | 2011-12-15 | Lilly Co Eli | Anti-abeta antikörper |
| JPWO2005105998A1 (ja) * | 2004-04-27 | 2008-07-31 | 財団法人化学及血清療法研究所 | ヒト抗アミロイドβペプチド抗体およびその抗体フラグメント |
| JP2008513732A (ja) * | 2004-07-02 | 2008-05-01 | ノースウエスタン ユニバーシティ | アミロイドβ(Abeta)の病理学的なアセンブリを標的とするモノクローナル抗体 |
| US20060024667A1 (en) | 2004-07-29 | 2006-02-02 | Karen Manucharyan | Compositions and methods for Alzheimer's disease |
| WO2006042158A2 (en) * | 2004-10-05 | 2006-04-20 | Wyeth | Methods and compositions for improving recombinant protein production |
| US9907485B2 (en) * | 2004-10-15 | 2018-03-06 | Brainlab Ag | Targeted immunization and plaque destruction against Alzheimer's disease |
| US9901413B2 (en) * | 2004-10-15 | 2018-02-27 | Brainlab Ag | Targeted infusion of agents for treatment of ALS |
| US9924888B2 (en) * | 2004-10-15 | 2018-03-27 | Brainlab Ag | Targeted infusion of agents against parkinson's disease |
| TW200636066A (en) * | 2004-12-15 | 2006-10-16 | Elan Pharm Inc | Humanized antibodies that recognize beta amyloid peptide |
| WO2006066089A1 (en) | 2004-12-15 | 2006-06-22 | Neuralab Limited | Humanized amyloid beta antibodies for use in improving cognition |
| AR051800A1 (es) * | 2004-12-15 | 2007-02-07 | Wyeth Corp | Anticuerpos a beta usados en mejorar la cognicion |
| EP1827493A4 (en) * | 2004-12-22 | 2009-09-30 | Univ St Louis | USE OF ANTI-ABETA ANTIBODIES FOR TREATING TRAUMATIC BRAIN INJURY |
| AU2006208226A1 (en) * | 2005-01-24 | 2006-08-03 | Amgen Inc. | Humanized anti-amyloid antibody |
| GT200600031A (es) | 2005-01-28 | 2006-08-29 | Formulacion anticuerpo anti a beta | |
| EP2388274A1 (en) | 2005-06-17 | 2011-11-23 | Janssen Alzheimer Immunotherapy | Methods of purifying anti A Beta antibodies |
| EP1954718B1 (en) | 2005-11-30 | 2014-09-03 | AbbVie Inc. | Anti-a globulomer antibodies, antigen-binding moieties thereof, corresponding hybridomas, nucleic acids, vectors, host cells, methods of producing said antibodies, compositions comprising said antibodies, uses of said antibodies and methods of using said antibodies |
| PT1976877E (pt) * | 2005-11-30 | 2014-04-29 | Abbvie Inc | Anticorpos monoclonais contra proteína beta-amilóide e suas utilizações |
| CA2632822C (en) * | 2005-12-12 | 2018-08-28 | Ruth Greferath | A beta 1-42 specific monoclonal antibodies with therapeutic properties |
| UA99097C2 (ru) | 2005-12-12 | 2012-07-25 | Ф. Хоффманн-Ля Рош Аг | Композиция, содержащая антитела к амилоиду бета 4, имеющие гликозилированный вариабельный участок |
| NZ571038A (en) * | 2006-03-30 | 2011-03-31 | Glaxo Group Ltd | Antibodies against amyloid-beta peptide |
| US8784810B2 (en) | 2006-04-18 | 2014-07-22 | Janssen Alzheimer Immunotherapy | Treatment of amyloidogenic diseases |
| CN101058608B (zh) * | 2006-04-21 | 2011-02-23 | 杜如昱 | 人类抗Aβ1-32淀粉样蛋白抗体、其纯化方法及用途 |
| EP3988566A1 (en) * | 2006-07-14 | 2022-04-27 | AC Immune SA | Humanized antibody against amyloid beta |
| WO2008011348A2 (en) * | 2006-07-14 | 2008-01-24 | Ac Immune S.A. | Humanized antibody against amyloid beta |
| SI2046833T1 (sl) * | 2006-07-14 | 2013-12-31 | Ac Immune S.A. | Humanizirano protitelo proti amiloidu beta |
| HUE033466T2 (en) * | 2006-10-02 | 2017-12-28 | Ac Immune Sa | Humanized antibody to beta-amyloid |
| US7744890B2 (en) | 2006-10-12 | 2010-06-29 | Wyeth Llc | Methods and compositions with reduced opalescence |
| US8455626B2 (en) | 2006-11-30 | 2013-06-04 | Abbott Laboratories | Aβ conformer selective anti-aβ globulomer monoclonal antibodies |
| WO2008084402A2 (en) | 2007-01-11 | 2008-07-17 | Philipps-Universitaet Marburg | Diagnosis and treatment of alzheimer's and other neurodementing diseases |
| KR101160385B1 (ko) | 2007-01-18 | 2012-07-10 | 일라이 릴리 앤드 캄파니 | 페길화된 Aβ FAB |
| AU2008215948A1 (en) | 2007-02-12 | 2008-08-21 | Merck & Co., Inc. | Piperazine derivatives for treatment of AD and related conditions |
| US20100311767A1 (en) | 2007-02-27 | 2010-12-09 | Abbott Gmbh & Co. Kg | Method for the treatment of amyloidoses |
| JP5930573B2 (ja) | 2007-03-01 | 2016-06-15 | プロビオドルグ エージー | グルタミニルシクラーゼ阻害剤の新規使用 |
| KR20100016661A (ko) * | 2007-04-18 | 2010-02-12 | 얀센 알츠하이머 이뮤노테라피 | 대뇌 아밀로이드 혈관병증의 예방 및 치료 |
| US8003097B2 (en) | 2007-04-18 | 2011-08-23 | Janssen Alzheimer Immunotherapy | Treatment of cerebral amyloid angiopathy |
| DK2142514T3 (da) | 2007-04-18 | 2015-03-23 | Probiodrug Ag | Thioureaderivater som glutaminylcyclase-inhibitorer |
| CA2687330A1 (en) | 2007-05-18 | 2008-11-27 | The Johns Hopkins University | A treatment simulator for brain diseases and method of use thereof |
| US20090232801A1 (en) * | 2007-05-30 | 2009-09-17 | Abbot Laboratories | Humanized Antibodies Which Bind To AB (1-42) Globulomer And Uses Thereof |
| JP2010528583A (ja) * | 2007-06-11 | 2010-08-26 | エーシー イミューン ソシエテ アノニム | アミロイドβに対するヒト化抗体 |
| US8048420B2 (en) | 2007-06-12 | 2011-11-01 | Ac Immune S.A. | Monoclonal antibody |
| US8613923B2 (en) | 2007-06-12 | 2013-12-24 | Ac Immune S.A. | Monoclonal antibody |
| CN101820911B (zh) * | 2007-06-12 | 2015-05-06 | Ac免疫有限公司 | β淀粉样蛋白的人源化抗体 |
| EP2182983B1 (en) | 2007-07-27 | 2014-05-21 | Janssen Alzheimer Immunotherapy | Treatment of amyloidogenic diseases with humanised anti-abeta antibodies |
| US8323647B2 (en) * | 2007-09-13 | 2012-12-04 | Delenex Therapeutics Ag | Humanized antibodies against the β-amyloid peptide |
| WO2009048539A2 (en) | 2007-10-05 | 2009-04-16 | Genentech, Inc. | Monoclonal antibody |
| BRPI0818621A8 (pt) * | 2007-10-05 | 2018-01-30 | Ac Immune Sa | composição farmacêutica, e, métodos para reduzir a carga da placa e a quantidade de placas na camada de célula de gânglio retinal de um indivíduo, para prevenir, tratar e/ou aliviar os efeitos de uma doença ocular, para diagnosticar uma doença ocular e uma predisposição a uma doença ocular, para monitorar doença ocular, para predizer responsividade de um paciente, e para reter ou diminuir pressão ocular nos olhos de um indivíduo |
| JO3076B1 (ar) | 2007-10-17 | 2017-03-15 | Janssen Alzheimer Immunotherap | نظم العلاج المناعي المعتمد على حالة apoe |
| NZ583632A (en) | 2007-11-16 | 2012-05-25 | Univ Rockefeller | Antibodies specific for the protofibril form of beta-amyloid protein |
| WO2009085200A2 (en) | 2007-12-21 | 2009-07-09 | Amgen Inc. | Anti-amyloid antibodies and uses thereof |
| EP2106802A1 (en) | 2008-04-02 | 2009-10-07 | SIGMA-TAU Industrie Farmaceutiche Riunite S.p.A. | Modified peptides as synthetic vaccines in amyloid-associated disease |
| EP2149380A1 (en) * | 2008-07-29 | 2010-02-03 | Medivet Pharma, S.L. | Veterinary immunotherapy compositions for the Aged Related Cognitive Dysfunction. |
| WO2010024927A2 (en) | 2008-08-28 | 2010-03-04 | The Research Foundation Of State University Of New York | Treatment of amyloidoses using myelin basic protein and fragments thereof |
| US9067981B1 (en) | 2008-10-30 | 2015-06-30 | Janssen Sciences Ireland Uc | Hybrid amyloid-beta antibodies |
| US8614297B2 (en) | 2008-12-22 | 2013-12-24 | Hoffmann-La Roche Inc. | Anti-idiotype antibody against an antibody against the amyloid β peptide |
| CA2772488C (en) | 2009-09-11 | 2018-04-17 | Probiodrug Ag | Heterocyclic derivatives as inhibitors of glutaminyl cyclase |
| HUE028105T2 (en) | 2009-12-11 | 2016-11-28 | Araclon Biotech Sl | Methods and Reagents for Improved Detection of Beta-Amyloid Peptides |
| EP2542581A4 (en) | 2010-03-01 | 2014-01-22 | David Gladstone Inst | SPECIFIC APOLIPOPROTEIN ANTIBODY AND METHODS OF USING SAME |
| JP6026284B2 (ja) | 2010-03-03 | 2016-11-16 | プロビオドルグ エージー | グルタミニルシクラーゼの阻害剤 |
| US8269019B2 (en) | 2010-03-10 | 2012-09-18 | Probiodrug Ag | Inhibitors |
| JP2013523182A (ja) | 2010-04-15 | 2013-06-17 | アボット・ラボラトリーズ | アミロイドベータ結合タンパク質 |
| EP2560953B1 (en) | 2010-04-21 | 2016-01-06 | Probiodrug AG | Inhibitors of glutaminyl cyclase |
| WO2011149461A1 (en) | 2010-05-27 | 2011-12-01 | Medtronic, Inc. | Anti-amyloid beta antibodies conjugated to sialic acid-containing molecules |
| RU2607368C2 (ru) | 2010-07-30 | 2017-01-10 | Ац Иммуне С.А. | Безопасные и функциональные гуманизированные антитела |
| CA2807552A1 (en) | 2010-08-06 | 2012-02-09 | Moderna Therapeutics, Inc. | Engineered nucleic acids and methods of use thereof |
| EP2603524A1 (en) | 2010-08-14 | 2013-06-19 | AbbVie Inc. | Amyloid-beta binding proteins |
| ES2862955T3 (es) | 2010-10-01 | 2021-10-08 | Modernatx Inc | Acidos nucleicos manipulados y métodos de uso de los mismos |
| US8530670B2 (en) | 2011-03-16 | 2013-09-10 | Probiodrug Ag | Inhibitors |
| JP5767393B2 (ja) | 2011-03-31 | 2015-08-19 | ファイザー・インク | 新規二環式ピリジノン |
| US8710200B2 (en) | 2011-03-31 | 2014-04-29 | Moderna Therapeutics, Inc. | Engineered nucleic acids encoding a modified erythropoietin and their expression |
| EP2511296A1 (en) | 2011-04-12 | 2012-10-17 | Araclón Biotech, S. L. | Antibody, kit and method for determination of amyloid peptides |
| WO2012172449A1 (en) | 2011-06-13 | 2012-12-20 | Pfizer Inc. | Lactams as beta secretase inhibitors |
| JP6043355B2 (ja) | 2011-08-31 | 2016-12-14 | ファイザー・インク | ヘキサヒドロピラノ[3,4−d][1,3]チアジン−2−アミン化合物 |
| JP2012050437A (ja) * | 2011-09-12 | 2012-03-15 | Janssen Alzheimer Immunotherapy | ベータアミロイドペプチドを認識するヒト化抗体 |
| US9464124B2 (en) | 2011-09-12 | 2016-10-11 | Moderna Therapeutics, Inc. | Engineered nucleic acids and methods of use thereof |
| WO2013052523A1 (en) | 2011-10-03 | 2013-04-11 | modeRNA Therapeutics | Modified nucleosides, nucleotides, and nucleic acids, and uses thereof |
| CN104114572A (zh) | 2011-12-16 | 2014-10-22 | 现代治疗公司 | 经修饰的核苷、核苷酸和核酸组合物 |
| SG11201403223PA (en) * | 2011-12-22 | 2014-07-30 | Hoffmann La Roche | Expression vector organization, novel production cell generation methods and their use for the recombinant production of polypeptides |
| US9572897B2 (en) | 2012-04-02 | 2017-02-21 | Modernatx, Inc. | Modified polynucleotides for the production of cytoplasmic and cytoskeletal proteins |
| US9878056B2 (en) | 2012-04-02 | 2018-01-30 | Modernatx, Inc. | Modified polynucleotides for the production of cosmetic proteins and peptides |
| US9283287B2 (en) | 2012-04-02 | 2016-03-15 | Moderna Therapeutics, Inc. | Modified polynucleotides for the production of nuclear proteins |
| EP2833920A2 (en) | 2012-04-02 | 2015-02-11 | Moderna Therapeutics, Inc. | Modified polynucleotides for the production of biologics and proteins associated with human disease |
| JP6110937B2 (ja) | 2012-05-04 | 2017-04-05 | ファイザー・インク | APP、BACE1、およびBACE2の阻害剤としての複素環式置換ヘキサヒドロピラノ[3,4−d][1,3]チアジン−2−アミン化合物 |
| SG11201408044QA (en) | 2012-06-29 | 2015-01-29 | Pfizer | NOVEL 4-(SUBSTITUTED-AMINO)-7H-PYRROLO[2,3-d]PYRIMIDINES AS LRRK2 INHIBITORS |
| AU2013287119A1 (en) * | 2012-07-03 | 2015-01-22 | Janssen Alzheimer Immunotherapy | C-terminal and central epitope a-beta antibodies |
| US9260455B2 (en) | 2012-09-20 | 2016-02-16 | Pfizer Inc. | Alkyl-substituted hexahydropyrano[3,4-d][1,3]thiazin-2-amine compounds |
| UA110688C2 (uk) | 2012-09-21 | 2016-01-25 | Пфайзер Інк. | Біциклічні піридинони |
| PL2922554T3 (pl) | 2012-11-26 | 2022-06-20 | Modernatx, Inc. | Na zmodyfikowany na końcach |
| WO2014091352A1 (en) | 2012-12-11 | 2014-06-19 | Pfizer Inc. | Hexahydropyrano [3,4-d][1,3]thiazin-2-amine compounds as inhibitors of bace1 |
| CA2893333C (en) | 2012-12-19 | 2017-10-24 | Pfizer Inc. | Carbocyclic-and heterocyclic-substituted hexahydropyrano[3,4-d][1,3]thiazin-2-amine compounds |
| JP2016507551A (ja) | 2013-02-13 | 2016-03-10 | ファイザー・インク | ヘテロアリール置換ヘキサヒドロピラノ[3,4−d][1,3]チアジン−2−アミン化合物 |
| US9233981B1 (en) | 2013-02-15 | 2016-01-12 | Pfizer Inc. | Substituted phenyl hexahydropyrano[3,4-d][1,3]thiazin-2-amine compounds |
| BR112015019276A2 (pt) | 2013-02-19 | 2017-07-18 | Pfizer | compostos de azabenzimidazol como inibidores de isoenzimas de pde4 para o tratamento de distúrbios do snc e outros distúrbios |
| US8980864B2 (en) | 2013-03-15 | 2015-03-17 | Moderna Therapeutics, Inc. | Compositions and methods of altering cholesterol levels |
| EP2999716A2 (en) | 2013-05-20 | 2016-03-30 | F. Hoffmann-La Roche AG | Anti-transferrin receptor antibodies and methods of use |
| EP3044323B1 (en) | 2013-09-13 | 2022-04-06 | F. Hoffmann-La Roche AG | Methods for detecting and quantifying host cell protein in cell lines |
| MX2016003202A (es) | 2013-09-13 | 2016-06-07 | Genentech Inc | Metodos y composiciones que comprenden polipeptidos recombinantes purificados. |
| WO2015048744A2 (en) | 2013-09-30 | 2015-04-02 | Moderna Therapeutics, Inc. | Polynucleotides encoding immune modulating polypeptides |
| EP3052521A1 (en) | 2013-10-03 | 2016-08-10 | Moderna Therapeutics, Inc. | Polynucleotides encoding low density lipoprotein receptor |
| ES2742078T3 (es) | 2013-10-04 | 2020-02-13 | Pfizer | Piridonas bicíclicas novedosas como moduladores de gamma-secretasa |
| US9695171B2 (en) | 2013-12-17 | 2017-07-04 | Pfizer Inc. | 3,4-disubstituted-1 H-pyrrolo[2,3-b]pyridines and 4,5-disubstituted-7H-pyrrolo[2,3-c]pyridazines as LRRK2 inhibitors |
| MD20160102A2 (ro) | 2014-04-01 | 2017-04-30 | Pfizer Inc. | Cromen şi 1,1a,2,7b-tetrahidrociclopropa[c]cromen piridopirazindione ca modulatori ai gama-secretazei |
| MX2016013329A (es) | 2014-04-10 | 2017-01-26 | Pfizer | 2-amino-6-metil-4,4a,5,6-tetrahidropirano[3,4-d][1,3]tiazin-8a(8h )-il-1,3-tiazol-4-ilamidas. |
| WO2015165961A1 (en) | 2014-04-29 | 2015-11-05 | Affiris Ag | Treatment and prevention of alzheimer's disease (ad) |
| US10131669B2 (en) | 2014-07-24 | 2018-11-20 | Pfizer Inc. | Pyrazolopyrimidine compounds |
| PL3177624T3 (pl) | 2014-08-06 | 2019-09-30 | Pfizer Inc. | Związki imidazopirydazynowe |
| US11008403B2 (en) | 2014-11-19 | 2021-05-18 | Genentech, Inc. | Anti-transferrin receptor / anti-BACE1 multispecific antibodies and methods of use |
| MX2017006663A (es) | 2014-11-19 | 2017-08-21 | Axon Neuroscience Se | Anticuerpos tau humanizados en enfermedad de alzheimer. |
| US10508151B2 (en) | 2014-11-19 | 2019-12-17 | Genentech, Inc. | Anti-transferrin receptor antibodies and methods of use |
| BR112017015693A2 (pt) | 2015-02-03 | 2018-03-20 | Pfizer | ciclopropabenzofuranil piridopirazinadionas |
| HUE051898T2 (hu) | 2015-06-17 | 2021-03-29 | Pfizer | Triciklusos vegyületek és alkalmazásuk foszfodiészteráz inhibitorokként |
| CA2991856A1 (en) | 2015-07-21 | 2017-01-26 | Bioarctic Neuroscience Ab | Method for treatment of traumatic brain injury targeting aggregated peptides |
| AU2016322813B2 (en) | 2015-09-14 | 2021-04-01 | Pfizer Inc. | Novel imidazo (4,5-c) quinoline and imidazo (4,5-c)(1,5) naphthyridine derivatives as LRRK2 inhibitors |
| EP3353182A1 (en) | 2015-09-24 | 2018-08-01 | Pfizer Inc | Tetrahydropyrano[3,4-d][1,3]oxazin derivatives and their use as bace inhibitors |
| AU2016325665A1 (en) | 2015-09-24 | 2018-03-08 | Pfizer Inc. | N-[2-(2-amino-6,6-disubstituted-4, 4a, 5, 6-tetrahydropyrano [3,4-d][1,3] thiazin-8a (8h)-yl) -1, 3-thiazol-4-yl] amides |
| EP3353174A1 (en) | 2015-09-24 | 2018-08-01 | Pfizer Inc | N-[2-(3-amino-2,5-dimethyl-1,1-dioxido-5,6-dihydro-2h-1,2,4-thiadiazin-5-yl)-1,3-thiazol-4-yl]amides useful as bace inhibitors |
| AR106189A1 (es) | 2015-10-02 | 2017-12-20 | Hoffmann La Roche | ANTICUERPOS BIESPECÍFICOS CONTRA EL A-b HUMANO Y EL RECEPTOR DE TRANSFERRINA HUMANO Y MÉTODOS DE USO |
| JP2019501115A (ja) | 2015-10-28 | 2019-01-17 | ザ・トラステイーズ・オブ・ザ・ユニバーシテイ・オブ・ペンシルベニア | 遺伝子治療のためのアデノ随伴ウイルスベクターのくも膜下腔内投与 |
| CA3004482A1 (en) | 2015-11-09 | 2017-05-18 | Neil R. Cashman | N-terminal epitopes in amyloid beta and conformationally-selective antibodies thereto |
| CA3004498A1 (en) | 2015-11-09 | 2017-05-18 | Neil R. Cashman | Amyloid beta epitopes and antibodies thereto |
| CN108350052A (zh) * | 2015-11-09 | 2018-07-31 | 英属哥伦比亚大学 | 淀粉样蛋白β中间区域中的表位及其构象选择性抗体 |
| US10323042B2 (en) | 2016-02-23 | 2019-06-18 | Pfizer Inc. | 6,7-dihydro-5H-pyrazolo[5,1-b][1,3]oxazine-2-carboxamide compounds |
| TWI798751B (zh) | 2016-07-01 | 2023-04-11 | 美商美國禮來大藥廠 | 抗-N3pGlu類澱粉β肽抗體及其用途 |
| ES2878160T3 (es) | 2016-07-01 | 2021-11-18 | Pfizer | Derivados de 5,7-dihidro-pirrolo-piridina para el tratamiento de enfermedades neurológicas y neurodegenerativas |
| CN109562167A (zh) | 2016-08-09 | 2019-04-02 | 伊莱利利公司 | 联合治疗 |
| CA3035080A1 (en) | 2016-09-27 | 2018-04-05 | Cero Therapeutics, Inc. | Chimeric engulfment receptor molecules |
| WO2018081642A1 (en) * | 2016-10-28 | 2018-05-03 | Washington University | Anti-apoe antibodies |
| US20180125920A1 (en) | 2016-11-09 | 2018-05-10 | The University Of British Columbia | Methods for preventing and treating A-beta oligomer-associated and/or -induced diseases and conditions |
| AU2018230109B2 (en) | 2017-03-10 | 2022-05-12 | Pfizer Inc. | Cyclic substituted imidazo[4,5-c]quinoline derivatives |
| JP7219223B2 (ja) | 2017-03-10 | 2023-02-07 | ファイザー・インク | LRRK2阻害剤としての新規のイミダゾ[4,5-c]キノリン誘導体 |
| JOP20190247A1 (ar) * | 2017-04-20 | 2019-10-20 | Lilly Co Eli | أجسام بيتا ببتيد النشوانية المضادة لـ N3pGlu واستخداماتها |
| US20230137562A1 (en) | 2017-06-07 | 2023-05-04 | Adrx, Inc. | Tau aggregation inhibitors |
| JP7263266B2 (ja) | 2017-06-22 | 2023-04-24 | ファイザー・インク | ジヒドロ-ピロロ-ピリジン誘導体 |
| MX2019015914A (es) | 2017-06-29 | 2020-08-06 | Univ Columbia | Anticuerpos quiméricos para el tratamiento de enfermedades por deposición de amiloide. |
| CA3070085A1 (en) | 2017-07-18 | 2019-01-24 | Promis Neurosciences Inc. | Antibodies to amyloid beta |
| US11382974B2 (en) | 2017-08-01 | 2022-07-12 | The Trustees Of Columbia University In The City Of New York | Methods and compositions for treatment of amyloid deposition diseases |
| US11453701B2 (en) | 2017-08-18 | 2022-09-27 | Adrx, Inc. | Tau aggregation peptide inhibitors |
| CA3073421A1 (en) | 2017-09-26 | 2019-04-04 | Daniel Mark COREY | Chimeric engulfment receptor molecules and methods of use |
| ES2812698T3 (es) | 2017-09-29 | 2021-03-18 | Probiodrug Ag | Inhibidores de glutaminil ciclasa |
| US20200330592A1 (en) * | 2017-10-09 | 2020-10-22 | Keith Black | Compositions and methods of treating alzheimer's and other amyloid related diseases |
| PT3768669T (pt) | 2018-03-23 | 2023-04-24 | Pfizer | Derivados de piperazina azaspiro |
| US20210015865A1 (en) | 2018-03-28 | 2021-01-21 | Cero Therapeutics, Inc. | Chimeric engulfment receptors and uses thereof for neurodegenerative diseases |
| WO2019226690A1 (en) * | 2018-05-21 | 2019-11-28 | New York University | Treatment of melanoma brain metastasis by inhibition of amyloid precursor protein cleavage |
| US20220031867A1 (en) | 2018-10-04 | 2022-02-03 | University Of Rochester | Glymphatic delivery by manipulating plasma osmolarity |
| AR117453A1 (es) | 2018-12-20 | 2021-08-04 | Genentech Inc | Fc de anticuerpos modificados y métodos para utilizarlas |
| FR3091999A1 (fr) * | 2019-01-25 | 2020-07-31 | Mexbrain | Dispositif d’extraction conjointe d’un cation métallique et d’une molécule cible |
| AU2020368369A1 (en) | 2019-10-15 | 2022-05-12 | Eli Lilly And Company | Recombinantly engineered, lipase/esterase-deficient mammalian cell lines |
| MX2023000949A (es) | 2020-07-23 | 2023-02-22 | Othair Prothena Ltd | Anticuerpos anti-beta-amiloide (abeta). |
| TW202243690A (zh) | 2021-01-11 | 2022-11-16 | 美商美國禮來大藥廠 | 抗N3pGlu類澱粉β抗體及其用途 |
| TW202300517A (zh) | 2021-03-12 | 2023-01-01 | 美商美國禮來大藥廠 | 抗類澱粉β抗體及其用途 |
| TW202300518A (zh) | 2021-03-12 | 2023-01-01 | 美商美國禮來大藥廠 | 抗N3pGlu類澱粉β抗體及其用途 |
| WO2022251048A1 (en) | 2021-05-24 | 2022-12-01 | Eli Lilly And Company | Anti-amyloid beta antibodies and uses thereof |
| WO2023150483A1 (en) | 2022-02-03 | 2023-08-10 | Eli Lilly And Company | Regional tau imaging for diagnosing and treating alzheimer's disease |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5766846A (en) * | 1992-07-10 | 1998-06-16 | Athena Neurosciences | Methods of screening for compounds which inhibit soluble β-amyloid peptide production |
Family Cites Families (36)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5278049A (en) * | 1986-06-03 | 1994-01-11 | Incyte Pharmaceuticals, Inc. | Recombinant molecule encoding human protease nexin |
| FR2608669A1 (fr) | 1986-12-19 | 1988-06-24 | Boussois Sa | Vitrage pret a sa pose et son procede de fabrication et de fixation |
| US4933156A (en) * | 1987-04-08 | 1990-06-12 | Salutar, Inc. | Amyloidosis and Alzheimer's disease diagnostic assay and reagents therefor |
| US5004697A (en) | 1987-08-17 | 1991-04-02 | Univ. Of Ca | Cationized antibodies for delivery through the blood-brain barrier |
| US5530101A (en) * | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| IL162181A (en) | 1988-12-28 | 2006-04-10 | Pdl Biopharma Inc | A method of producing humanized immunoglubulin, and polynucleotides encoding the same |
| GB8928874D0 (en) | 1989-12-21 | 1990-02-28 | Celltech Ltd | Humanised antibodies |
| US5753624A (en) | 1990-04-27 | 1998-05-19 | Milkhaus Laboratory, Inc. | Materials and methods for treatment of plaquing disease |
| US5837822A (en) * | 1992-01-27 | 1998-11-17 | Icos Corporation | Humanized antibodies specific for ICAM related protein |
| US5837672A (en) | 1992-07-10 | 1998-11-17 | Athena Neurosciences, Inc. | Methods and compositions for the detection of soluble β-amyloid peptide |
| EP1298436B1 (en) * | 1992-10-26 | 2010-07-14 | Elan Pharmaceuticals, Inc. | Methods for the identification of Beta-amyloid peptide (BAP) release inhibitor compounds |
| CA2115900A1 (en) | 1993-02-22 | 1994-08-23 | Gerald W. Becker | Pharmaceutical screens and antibodies |
| AU7845194A (en) * | 1993-09-28 | 1995-04-18 | General Hospital Corporation, The | Using antisense oligonucleotides to modulate nerve growth and to reverse beta/A4 amyloid-induced morphology |
| WO1995020979A1 (en) | 1994-02-03 | 1995-08-10 | The Picower Institute For Medical Research | Compositions and methods for advanced glycosylation endproduct-mediated modulation of amyloidosis |
| US5688651A (en) | 1994-12-16 | 1997-11-18 | Ramot University Authority For Applied Research And Development Ltd. | Prevention of protein aggregation |
| US5786180A (en) | 1995-02-14 | 1998-07-28 | Bayer Corporation | Monoclonal antibody 369.2B specific for β A4 peptide |
| US6037454A (en) * | 1996-11-27 | 2000-03-14 | Genentech, Inc. | Humanized anti-CD11a antibodies |
| US6218506B1 (en) | 1997-02-05 | 2001-04-17 | Northwestern University | Amyloid β protein (globular assembly and uses thereof) |
| NZ337765A (en) | 1997-04-09 | 2001-09-28 | Mindset Biopharmaceuticals Usa | Recombinant antibodies having specificity for beta-amyloid N-terminus and C-terminus and use in treating Alzheimer's Disease |
| US20020086847A1 (en) | 1997-04-09 | 2002-07-04 | Mindset Biopharmaceuticals (Usa) | Recombinant antibodies specific for beta-amyloid ends, DNA encoding and methods of use thereof |
| US6787319B2 (en) | 1997-04-16 | 2004-09-07 | American Home Products Corp. | β-amyloid peptide-binding proteins and polynucleotides encoding the same |
| IT1293511B1 (it) | 1997-07-30 | 1999-03-01 | Gentili Ist Spa | Anticorpi monoclonali catalitici ad attivita' proteasica per la lisi selettiva della componente proteica di placche e aggregati correlati |
| AU8777898A (en) | 1997-08-11 | 1999-03-01 | Chiron Corporation | Methods for genetically modifying t cells |
| TWI239847B (en) * | 1997-12-02 | 2005-09-21 | Elan Pharm Inc | N-terminal fragment of Abeta peptide and an adjuvant for preventing and treating amyloidogenic disease |
| US7964192B1 (en) * | 1997-12-02 | 2011-06-21 | Janssen Alzheimer Immunotherapy | Prevention and treatment of amyloidgenic disease |
| AU4007599A (en) | 1998-05-21 | 1999-12-06 | University Of Tennessee Research Corporation, The | Methods for amyloid removal using anti-amyloid antibodies |
| UA81216C2 (en) | 1999-06-01 | 2007-12-25 | Prevention and treatment of amyloid disease | |
| EP1409654B1 (en) * | 1999-06-16 | 2008-08-20 | Boston Biomedical Research Institute | Immunological control of beta-amyloid levels in vivo |
| AU6524500A (en) | 1999-08-04 | 2001-03-05 | Northwestern University | Amyloid beta protein (globular assembly and uses thereof) |
| US6919075B1 (en) | 1999-09-03 | 2005-07-19 | Ramot At Tel Aviv University Ltd. | Bacteriophage displaying aβ epitopes and method of use |
| US6294171B2 (en) | 1999-09-14 | 2001-09-25 | Milkhaus Laboratory, Inc. | Methods for treating disease states comprising administration of low levels of antibodies |
| AU4178601A (en) | 2000-02-24 | 2001-09-03 | Univ Washington | Humanized antibodies that sequester abeta peptide |
| US20020009445A1 (en) | 2000-07-12 | 2002-01-24 | Yansheng Du | Human beta-amyloid antibody and use thereof for treatment of alzheimer's disease |
| ATE441663T1 (de) | 2000-09-06 | 2009-09-15 | Aventis Pharma Sa | Verfahren und zusammensetzungen für amyloidosis- verbundene krankheiten |
| TWI255272B (en) | 2000-12-06 | 2006-05-21 | Guriq Basi | Humanized antibodies that recognize beta amyloid peptide |
| CA2457145C (en) | 2001-08-17 | 2010-12-21 | Washington University | Assay method for alzheimer's disease |
-
2001
- 2001-02-26 AU AU4178601A patent/AU4178601A/xx active Pending
- 2001-02-26 PL PL386125A patent/PL218883B1/pl unknown
- 2001-02-26 MX MXPA02008145A patent/MXPA02008145A/es active IP Right Grant
- 2001-02-26 DE DE1257584T patent/DE1257584T1/de active Pending
- 2001-02-26 PT PT40114662T patent/PT1481992T/pt unknown
- 2001-02-26 SI SI200131058A patent/SI1481992T1/sl unknown
- 2001-02-26 WO PCT/US2001/006191 patent/WO2001062801A2/en active Application Filing
- 2001-02-26 CN CN201410322976.0A patent/CN104341500A/zh active Pending
- 2001-02-26 HU HU0204074A patent/HUP0204074A3/hu unknown
- 2001-02-26 LT LTEP04011466.2T patent/LT1481992T/lt unknown
- 2001-02-26 EA EA200200897A patent/EA006606B1/ru not_active IP Right Cessation
- 2001-02-26 DE DE60106394T patent/DE60106394T3/de not_active Expired - Lifetime
- 2001-02-26 EP EP01913081A patent/EP1257584B2/en not_active Expired - Lifetime
- 2001-02-26 CZ CZ2008-595A patent/CZ306683B6/cs not_active IP Right Cessation
- 2001-02-26 KR KR1020027011027A patent/KR100767146B1/ko active IP Right Grant
- 2001-02-26 DK DK04011466.2T patent/DK1481992T3/en active
- 2001-02-26 TR TR2002/02799T patent/TR200202799T3/xx unknown
- 2001-02-26 CN CN200810214672.7A patent/CN101670105B/zh not_active Expired - Lifetime
- 2001-02-26 ES ES04011466.2T patent/ES2611427T3/es not_active Expired - Lifetime
- 2001-02-26 CN CN018084303A patent/CN1426423B/zh not_active Expired - Lifetime
- 2001-02-26 UA UA2002086888A patent/UA75881C2/uk unknown
- 2001-02-26 DK DK01913081.4T patent/DK1257584T4/da active
- 2001-02-26 PT PT01913081T patent/PT1257584E/pt unknown
- 2001-02-26 PL PL356798A patent/PL210157B1/pl unknown
- 2001-02-26 SK SK12212002A patent/SK288711B6/sk not_active IP Right Cessation
- 2001-02-26 SK SK69-2008A patent/SK288723B6/sk not_active IP Right Cessation
- 2001-02-26 AT AT01913081T patent/ATE279442T1/de active
- 2001-02-26 DZ DZ013295A patent/DZ3295A1/fr active
- 2001-02-26 SI SI200130240T patent/SI1257584T2/sl unknown
- 2001-02-26 JP JP2001562582A patent/JP4738696B2/ja not_active Expired - Lifetime
- 2001-02-26 ES ES01913081T patent/ES2184660T5/es not_active Expired - Lifetime
- 2001-02-26 BR BRPI0108676A patent/BRPI0108676B8/pt not_active IP Right Cessation
- 2001-02-26 IL IL15137801A patent/IL151378A0/xx unknown
- 2001-02-26 EP EP16196667.6A patent/EP3150633A1/en not_active Withdrawn
- 2001-02-26 NZ NZ520800A patent/NZ520800A/en not_active IP Right Cessation
- 2001-02-26 EP EP16161726.1A patent/EP3070100B1/en not_active Expired - Lifetime
- 2001-02-26 EP EP04011466.2A patent/EP1481992B1/en not_active Expired - Lifetime
- 2001-02-26 CA CA2400559A patent/CA2400559C/en not_active Expired - Lifetime
- 2001-02-26 CZ CZ2002-2851A patent/CZ304211B6/cs not_active IP Right Cessation
-
2002
- 2002-08-20 NO NO20023957A patent/NO329840B1/no not_active IP Right Cessation
- 2002-08-21 US US10/226,435 patent/US7195761B2/en not_active Expired - Lifetime
- 2002-08-21 IL IL151378A patent/IL151378A/en active IP Right Grant
- 2002-08-21 ZA ZA200206712A patent/ZA200206712B/en unknown
- 2002-08-22 HR HR20020693A patent/HRP20020693B1/xx not_active IP Right Cessation
-
2003
- 2003-01-02 HK HK03100011.2A patent/HK1048640B/zh active IP Right Maintenance
-
2005
- 2005-09-12 US US11/224,623 patent/US20060039906A1/en not_active Abandoned
-
2008
- 2008-02-08 US US12/028,641 patent/US7892545B2/en not_active Expired - Fee Related
- 2008-08-21 IL IL193631A patent/IL193631A/en active IP Right Grant
- 2008-09-03 HR HRP20080430AA patent/HRP20080430B1/hr not_active IP Right Cessation
- 2008-09-04 NO NO20083805A patent/NO337363B1/no not_active IP Right Cessation
- 2008-09-19 JP JP2008240971A patent/JP4914412B2/ja not_active Expired - Lifetime
-
2010
- 2010-12-22 US US12/976,282 patent/US8591894B2/en not_active Expired - Lifetime
-
2011
- 2011-02-26 HU HU0800571A patent/HU230768B1/hu unknown
-
2016
- 2016-12-15 CY CY20161101301T patent/CY1118381T1/el unknown
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5766846A (en) * | 1992-07-10 | 1998-06-16 | Athena Neurosciences | Methods of screening for compounds which inhibit soluble β-amyloid peptide production |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1426423B (zh) | 螯合淀粉样蛋白β肽的人源化抗体 | |
| US10646568B2 (en) | Targeting immunotherapy for amyloidosis | |
| ES2437875T3 (es) | Anticuerpos humanizados que reconocen el péptido beta-amiloide | |
| JP5058261B2 (ja) | 抗ミオスタチン抗体 | |
| CN100595210C (zh) | 淀粉样β(1-42)蛋白寡聚体、其衍生物及抗体、其制备方法和用途 | |
| ES2312569T3 (es) | Anticuerpos humanizados. | |
| CN101155831B (zh) | 抗干扰素α单克隆抗体及其使用方法 | |
| CN105339002B (zh) | 治疗tau病变的方法 | |
| CN104736185A (zh) | 治疗Tau病变的方法 | |
| BR112019026907A2 (pt) | Anticorpos apenas de cadeia pesadaanti-bcma, polinucleotídeo, vetor, célula,composição farmacêutica, seus usos e método paraproduzir os mesmos | |
| PT2260055E (pt) | Anticorpos monoclonais contra a proteína rgm a e seus usos | |
| CN109562167A (zh) | 联合治疗 | |
| KR20220027825A (ko) | 항-EphA4 항체 | |
| JP2022519293A (ja) | コネキシン43抗体およびその使用 | |
| JP2018508193A (ja) | メディンを認識する抗体 | |
| WO2017211313A1 (zh) | 长效pcsk9特异性的结合蛋白及其应用 | |
| JP2022121306A (ja) | 抗β2ミクログロブリン抗体およびその使用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| CX01 | Expiry of patent term | ||
| CX01 | Expiry of patent term |
Granted publication date: 20100512 |